
| A. | 减小反应物浓度,可减小单位体积内活化分子的百分数,从而使有效碰撞次数减少 | |
| B. | 对于有气体参加的化学反应,若减小压强(即扩大反应容器的体积),可减小活化分子的百分数,从而使反应速率减小 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 能量高的分子一定能发生有效碰撞 |
分析 A.减小反应物浓度,降低单位体积内活化分子个数;
B.对于有气体参加的化学反应,若减小压强(即扩大反应容器的体积),可减小单位体积内活化分子个数;
C.改变条件能使化学反应速率增大的主要原因是增大活化分子百分数或增大单位体积内活化分子个数;
D.能量高的分子不一定生有效碰撞.
解答 解:A.减小反应物浓度,降低单位体积内活化分子个数,从而降低反应速率,故A错误;
B.对于有气体参加的化学反应,若减小压强(即扩大反应容器的体积),可减小单位体积内活化分子个数,从而降低反应速率,故B错误;
C.改变条件能使化学反应速率增大的主要原因是增大活化分子百分数或增大单位体积内活化分子个数,从而增大反应物分子中活化分子的有效碰撞几率,化学反应速率增大,故C正确;
D.能量高的分子不一定生有效碰撞,但发生有效碰撞的分子一定是能量高的分子,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确化学反应速率改变原理是解本题关键,知道哪些因素导致活化分子个数增大、哪些因素导致活化分子百分数增大,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A. | 离子半径大小:R3+<X+<M2- | |
| B. | Y与M组成的化合物是光化学烟雾的原因之一 | |
| C. | 将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 | |
| D. | R的单质是铝热剂的成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
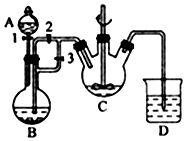 (1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
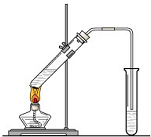 实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
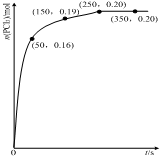 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com