
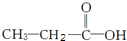 和
和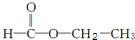 两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.
两种,为对其结构进行物理方法鉴定,常用红外光谱和核磁共振氢谱法.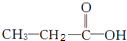 ,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰.
,则红外光谱中应该有5个吸收峰;核磁共振氢谱中应有4个吸收峰. ,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰.
,则红外光谱中应该有4个吸收峰;核磁共振氢谱中应有3个吸收峰. 分析 (1)根据相对密度计算X的相对分子质量,再计算X、二氧化碳、水的物质的量,根据原子守恒计算C、H原子数目,结合相对分子质量计算O原子数目;
(2)不同的化学键或官能团吸收频率不同,红外光谱图中处于不同的位置,一般原子之间形成的不同化学键种类等于吸收峰数;核磁共振氢谱吸收峰等于分子中H原子种类.
解答 解:(1)X的相对分子质量为30×2=60,故1.5g X的物质的量为$\frac{1.5g}{60g/mol}$=0.025mol,
二氧化碳物质的量为$\frac{1.68L}{22.4L/mol}$=0.075mol,水的物质的量为$\frac{1.8g}{18g/mol}$=0.1mol,
故X分子中C原子数目为$\frac{0.075mol}{0.025mol}$=3,H原子数目为$\frac{0.1mol×2}{0.025mol}$=8,则O原子数目为$\frac{60-12×3-8}{16}$=1,
故X的分子式为C3H8O,
故答案为:C3H8O;
(2)①有机物Y若为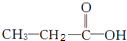 ,含有C-H、C-C、C-O、C=O、O-H键,红外光谱中应该有5个吸收峰;分子中含有3种化学环境不同的H原子,核磁共振氢谱中应有3个吸收峰,
,含有C-H、C-C、C-O、C=O、O-H键,红外光谱中应该有5个吸收峰;分子中含有3种化学环境不同的H原子,核磁共振氢谱中应有3个吸收峰,
故答案为:5;3;
②有机物Y若为 ,含有C-H、C-C、C-O、C=O键,红外光谱中应该有4个吸收峰;分子中含有3种化学环境不同的H原子,核磁共振氢谱中应有3个吸收峰,
,含有C-H、C-C、C-O、C=O键,红外光谱中应该有4个吸收峰;分子中含有3种化学环境不同的H原子,核磁共振氢谱中应有3个吸收峰,
故答案为:4;3.
点评 本题考查有机物分子式与结构的确定,掌握燃烧法利用原子守恒确定有机物分子式,注意对质谱图、红外光谱法、核磁共振氢谱的简单识读.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:A3++4NH3•H2O═AlO-+4NH4++2H2O | |
| B. | 少量双氧水滴人酸性KI溶液:2H202+2I-═2H++4H20+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-═3Fe3++NO+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一═2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
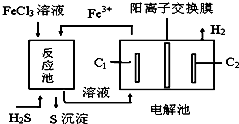
| A. | 电解池中惰性电极C1为阳极 | |
| B. | 该工艺优点之一是FeCl3溶液可循环利用 | |
| C. | 反应池中的离子方程式:2Fe3++S2-=2Fe2++S↓ | |
| D. | 电解池总反应的化学方程式:2FeCl2+2HCl$\frac{\underline{\;通电\;}}{\;}$2FeCl3+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 乙醇(乙酸) | KOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
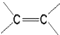 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 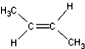 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com