
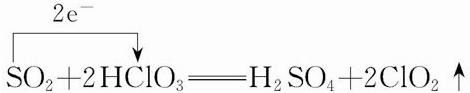 .
.分析 有X、Y、Z三种元素,Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色,为FeCl3,故Z为Fe元素,Y为Cl元素,X2-、Y-均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素.
(1)Cl元素的最高价氧化物对应水化物的化学式是HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,所形成的溶液具有胶体的性质,氢氧化铁胶体胶粒带正电荷,会发生电泳现象,溶液中含有氯离子,将溶液蒸干促进水解,最终氢氧化铁分解生成氧化铁;
(3)硫单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2.
①根据反应热计算参加反应的二氧化硫的物质的量,再利用转化率定义计算;
②Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3,该酸具有强氧化性,将二氧化硫氧化为硫酸,Cl元素在氧化物中化合价为x,则(5-x)×1.5×6.02×1023=1.5×6.02×1023,解得x=4,故氧化物为ClO2,反应方程式为:SO2+2HClO3=H2SO4+2ClO2;
(4)盐酸溶液中氢氧根离子浓度等于水电离的氢离子浓度,氯化铁溶液中氢离子浓度源于水的电离.
解答 解:有X、Y、Z三种元素,Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色,为FeCl3,故Z为Fe元素,Y为Cl元素,X2-、Y-均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素,
(1)Cl元素的最高价氧化物对应水化物的化学式是HClO4,故答案为:HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,反应的离子方程式是Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
A.氢氧化铁胶体具有丁达尔效应,则光束通过该液体时形成光亮的“通路”,故A正确;
B.胶体胶粒带有正电荷,通直流电后,发生电泳现象,负极附近液体颜色加深,故B正确;
C.所得的溶液中含有氯离子,向该液体中加入硝酸银溶液,有沉淀产生,故C错误;
D.将该液体加热、蒸干、灼烧后,有氧化铁生成,故D正确;
故答案为:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;ABD;
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,
①发生反应2SO2+O2?2SO2,1molSO2被O2氧化放热98.0kJ,若2mol该气体与1mol O2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,故参加反应的SO2为$\frac{176.4kJ}{98kJ}$×1mol=1.8mol,故SO2转化率为$\frac{1.8mol}{2mol}$×100%=90%,
故答案为:90%;
②Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3,SO2与含1.5molHClO3溶液在一定条件下反应,可生成一种强酸为和一种氧化物,该强酸为H2SO4,Cl元素在氧化物中化合价为x,则(5-x)×1.5×6.02×1023=1.5×6.02×1023,解得x=4,故氧化物为ClO2,反应方程式为:SO2+2HClO3=H2SO4+2ClO2,用单线桥表示电子转移方向和数目: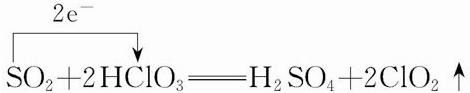 ,
,
故答案为: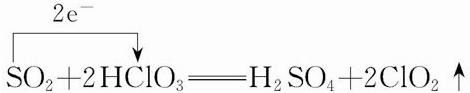 ;
;
(4)盐酸抑制水的电离,氯化铁水解促进水的电离,则室温时,pH=5的HY溶液和pH=5的ZY3溶液中,水电离出的氢离子分别是$\frac{10-14}{1{0}^{-5}}$mol/L=10-9mol•L-1和10-5mol•L-1,
故答案为:10-9;10-5.
点评 本题以元素推断为载体,考查常用化学用语书写、胶体性质、氧化还原反应计算、反应热与化学平衡计算、电解质溶液中离子平衡问题,题目综合性较大,难度中等,(3)中注意利用氧化还原反应规律计算氯元素在氧化物中的化合价.


科目:高中化学 来源: 题型:选择题
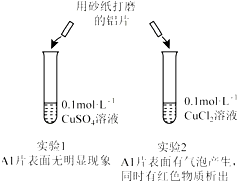
| A. | 由实验1 可以得出结论:金属铝的活泼性弱于金属铜 | |
| B. | 实验2 中生成红色物质的离子方程式:Al+Cu2+═Al3++Cu | |
| C. | 溶液中阴离子种类不同是导致实验1、2 出现不同现象的原因 | |
| D. | 由上述实验可推知:用砂纸打磨后的铝片分别与浓度均为0.2mol•L-1的盐酸和硫酸反应,后者更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
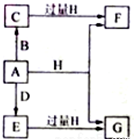 A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.
A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性.它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题.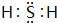 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
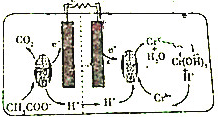 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学品,下列有关说法正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 得到的有价值的化学品为CO2和Cr(OH)3 | |
| C. | 右室中的电极为负极 | |
| D. | 1molCH3COO-转化为CO2得到4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中I-:取样→滴加氯水→再滴加淀粉溶液,溶液变蓝 | |
| B. | 检验溶液中的Fe2+:取样$\stackrel{KSCN溶液}{→}$无明显现象$\stackrel{KMnO_{4}}{→}$红色溶液 | |
| C. | 证明氧化性Fe3+>Cu2+:向FeCl3、CuCl2混合液中加入少量铁粉,无红色固体产生 | |
| D. | 配制0.5mol•L-1的CuSO4溶液:用天平称取12.5g CuSO4•5H2O配成100mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钾溶液 | B. | 纯碱溶液 | C. | 碳酸氢钙溶液 | D. | 小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CS2为V形的极性分子 | |
| B. | Cl03- 的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32- 的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;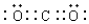 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com