
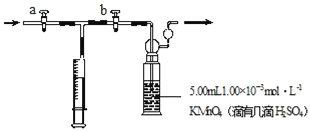
����Ŀ���ҹ��涨�����ڼ�ȩ�������ó���0.08mgm��3��ij�о���ѧϰС������������KMnO4��Һ�ⶨ�����м�ȩ�ĺ���������Э������������ѧϰ������װ����ͼ�����䷴Ӧԭ�����������£�
4MnO4��+5HCHO+H+�TMn2++5CO2��+11H2O
2MnO4��+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O
���裺����ȡ5.00mL 1.00��10��3molL��1 KMnO4����Һ��ϴ��ƿ�У������뼸��ϡH2SO4����ˮ20mLϡ�ͱ�����
��ȡ1.00��10��3molL��1�������Һ����ʽ�ζ����б�����
����ע������ȡ100mL��װ�����ڿ������ٽ�ע������������ϴ��ƿ�г�ַ�Ӧ�����ظ�4����
�ܽ�ϴ��ƿ����Һת�Ƶ���ƿ�У�����ϴ��Һ�������ñ�������Һ���еζ�����¼�ζ������ĵIJ�����Һ�������
�����ظ�ʵ��2�Σ�ÿ��ȡ���������Һ5.00mL����3��ʵ�����IJ�����Һ�����ƽ��ֵΪ12.38mL��
�ش���������
��1��5.00mL���������_____��ȡ��
��2����ʵ����ָʾ��_____������ĸ����
a���ȡ�b��̪��c���ۡ�d�������������Լ�
��3������þ����ڿ����м�ȩ��Ũ��_____mgm��3��
��4�����в������������ڼ�ȩŨ��ƫ�ߵ���_____��
a���ζ��յ㸩�Ӷ���
b���ζ�ǰ�����ݵζ���������
c���ڸ��������Һ�м�������ˮ
d��װ����ĵζ���δ��ϴ
��5�������Ƕ�Ԫ��ǿ�ᣬ����������Һ�����ԣ������£������10 mL 0.01molL��1H2C2O4��Һ�еμ�0.01 molL��1NaOH��Һ
�ٵ������NaOH��Һ���Ϊ10mL������д����Һ�������غ��ϵʽ_____��
�ڵ������NaOH��Һ���Ϊ20mL������д����Һ�����ӵ�Ũ�ȴ�С��ϵ_____��
���𰸡� ��ʽ�ζ��� d 18 a c��H+��+c��H2C2O4��=c��OH����+c��C2O42���� c��Na+����c��C2O42������c��OH������c��HC2O4������c��H+��
����������1�����⿼��ζ�ʵ�飬ע��ζ���ѡȡ�����ķ����� ���������Һ����ǿ�����ԣ���ʽ�ζ����¶���һ����������ض����и�ʴ�ԣ���˸������ʢ������ʽ�ζ����У���2�����������Һ��������ɫ����˲���Ҫָʾ������ѡ��d��ȷ����3���������ӷ�Ӧ����ʽ������ᷴӦ�ĸ�����ص����ʵ���Ϊ12.38��10��3��1��10��3��2/5mol=4.952��10��6mol�����ݸ���������ȩ��Ӧ�����ӷ�Ӧ����ʽ�����ļ�ȩ�����ʵ���Ϊ��5��10��3��1��10��3��4.952��10��6����5/4mol=6��10��8mol��������Ϣ������ȡ����500ml����˼�ȩ��Ũ��Ϊ6��10��8��30��103/500��10��6mg/m3=3.6 mg/m3����4��a���ζ�ʱ���Ӷ��������IJ���������С�������ȩ��Ӧ�ĸ�����ص������ӣ������ļ�ȩ��Ũ��ƫ�ߣ�����ȷ��b���ζ�ǰ�����ݵζ��������ݣ����IJ����������ӣ����ȩ��Ӧ�ĸ�����ص�����С�������ļ�ȩ��Ũ��ƫ�ͣ��ʴ���c�����������Һ��ˮ��������ص����ʵ������䣬���ȩ��Ũ�Ȳ��䣬�ʴ���d��ʢװ����ĵζ���Ϊ��ϴ�������Ũ��ƫС�����IJ��������������ȩ��Ӧ�ĸ�����ص�����С����ļ�ȩ��Ũ��ƫ�ͣ��ʴ���5�����⿼������Ũ�ȴ�С�ıȽϣ���������ʵ��������ˮ���ص����֣�һ���֣�������������NaOH10mL����Һ������ΪNaHC2O4�������غ㣺c(Na��)=c(HC2O4��)��c(C2O42��)��c(H2C2O4) ������غ㣺c(Na��)��c(H��)=c(HC2O4��)��c(OH��)��2c(C2O42��)����������غ�Ϊ�� c(H��)+ c(H2C2O4)= c(OH��)+ c(C2O42��) ����������NaOH�����Ϊ20mLʱ����Һ������ΪNa2C2O4��C2O42������ˮ�⣺C2O42����H2O ![]() HC2O4����OH������Һ�Լ��ԣ�����ˮҲ�������룬H2O
HC2O4����OH������Һ�Լ��ԣ�����ˮҲ�������룬H2O ![]() H����OH��������ˮ��ij̶������������Ũ�ȴ�С˳���ǣ�c(Na��)��c(C2O42��)��c(OH��)��c(HC2O4��)��c(H��)��
H����OH��������ˮ��ij̶������������Ũ�ȴ�С˳���ǣ�c(Na��)��c(C2O42��)��c(OH��)��c(HC2O4��)��c(H��)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��Dԭ�������������ӡ�X��Y��Z��W����������Ԫ���е�������ɳ����Ļ����YΪ����ɫ���壬��Ϊ���嵥�ʣ���Ϊ����ɫ���壬��������֮���ת����ϵ����ͼ��ʾ�����ַ�Ӧ���������ʡ�ԣ���������˵����ȷ����
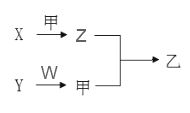
A. ԭ�Ӱ뾶:D>C>B>A
B. C��D���⻯���Ϊ���ۻ�����
C. ͼʾת����ϵ�漰�ķ�Ӧ��Ϊ������ԭ��Ӧ
D. �����̬�⻯����ȶ��ԣ�B>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A(g)��5B(g) ��4C(g)��6��(g)����5 L���ܱ������н��У�����Ӻ�C�����ʵ���������0��30 mol������������ȷ����
A�������к�D���ʵ�������Ϊ0��45 mol
B��A��ƽ����Ӧ������0��010 mol��L��1��s��1
C��������A��B��C��D�����ʵ���֮��һ����4��5��4��6
D��������A�����ʵ���һ��������0��30 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A����ҵ�������������ʯ��ˮ��Ӧ��ȡƯ��
B��������������Ӧ��Һ�Ȳ��������ڸ�ƿ��
C�����ȼҵ���У����ȡ�ָ�������������ָ�����ռ�
D��������ˮ��ɱ����������ΪCl2�ж����ܶ�ɱϸ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 m L 0.1mol/L Na2S ��Һ����μ���50 mL 0.1mol/L KHSO4��Һ��������Һ������Ũ�ȹ�ϵ��ȷ����
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת��������������ԭ��Ӧ�ص��ǣ�������
A.��̫���ܵ�ع���ʱ������ת���ɵ���
B.����ӵ�طŵ�ʱ����ѧ��ת���ɵ���
C.�������Һ����ʱ������ת���ɻ�ѧ��
D.������Ϊ����������ṩ����ʱ����ѧ��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������γɵ���Ҫԭ����
A. ����ʹ��Ũ���� B. ��Ȼ��������ֽ�
C. ��ҵ����ʹ�ú���ȼ�� D. ��ȼ��ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˹��ϳ��л�������H��·�߿���ʾ���£�
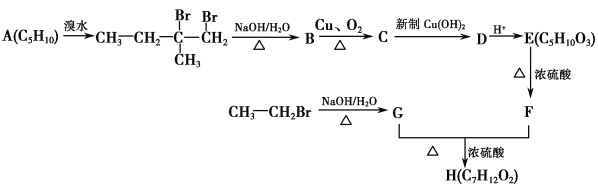
��֪��F�ĺ˴Ź����������ĸ�������������Ϊ1��1��3��3��
��ش��������⣺
(1)A������(ϵͳ����)Ϊ________��C�й����ŵĽṹ��ʽΪ____________________________��
(2)G��F�D��H�ķ�Ӧ����Ϊ________��H�Ľṹ��ʽΪ________��
(3)C�D��D�����ӷ���ʽΪ__________________________��
(4)E��һ�����������ɵĸ߷��ӻ�����Ľṹ��ʽΪ_________________________________��
(5)X��F��ͬ���칹������ͬʱ��������3�����������ܷ���ˮ�ⷴӦ���������������ܷ���������Ӧ����X���ܵĽṹ��ʽΪ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֱ���������ϡ���������������Һ��Ӧʱ����������Ӧ�ų�����������ͬ״���µ�������ʱ����Ӧ�����ĵ��������������Ƶ����ʵ���֮��Ϊ
A. 1��1 B. 1��3 C. 3��1 D. 4��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com