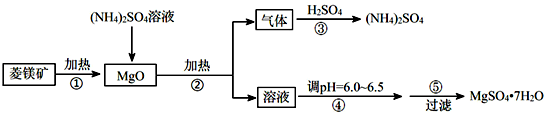
一碳化学是指以研究分子中只含有一个碳原子的化合物(如CH
4、CO
2、CH
3OH等)为原料来合成一系列化工原料和燃料的化学.科学家提出一种“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO
2从溶液中提取出来,经化学反应后使空气中的CO
2转变为其它化工原料,如图所示:

(1)分解池通入高温水蒸气的作用是
.
(2)目前工业上可用CO
2生产
甲醇燃料,反应的化学方程式为:CO
2(g)+3H
2?CH
3OH(g)+H
2O(g)△H.
已知:
| 共价键 | C=O | H-H | C-O | C-H | O-H |
| 键能KJ?mol-1 | 750 | 436 | 358 | 413 | 463 |
①该反应的平衡常数的表达式K=
.
②该反应△H=
KJ?mol
-1③用甲醇可以设计成燃料电池,应用于电脑、汽车等能量的来源.设计较多的是由甲醇负极、氧正极和质子交换膜构成,写出负极的电极反应式
.
④已知25℃℃、101kPa下,2.0g液态甲醇完全燃烧生成液态水时放出45.4KJ的热量,则甲醇的标准燃烧热为
KJ?mol
-1.
⑤为了提高甲醇的日生产量,可采取的措施是
.
A.减小压强 B.使用合适的催化剂 C.温度越低越好 D.控制适当的温度

(3)CO
2(g)+2CH
4(OH)(g)?CH
3OCOOCH
3(g)+H
2O(g)△H,控制一定条件,该反应能自发进行,即△H
0(填写>、<、=).在恒温容积可变的容器中加入1 mol CO
2、2 molCH
3OH.CO
2的转化率与反应时间关系如图1示.在反应过程中加压,若t
1时容器体积为1000mL,则 t
2时容器体积V=
mL.
(4)过氧化尿素合成反应式如下:CO(NH
2)
2+H
2O
2→CO(NH
2)
2?H
2O
2△H<0.当n(过氧化氢):n(尿素)为1.3:1,反应时间45min,用水杨酸作为稳定剂,分别考察反应温度对反应效果的影响如图2示[活性氧含量可视为CO(NH
2)
2?H
2O
2产量的直观表示].从图2可以看出,在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少.
①根据图2信息,最佳反应温度为
.
②如何说明该反应中在实验选定的温度范围内,随反应温度的升高,产品活性氧含量先增加而随后减少
.





 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
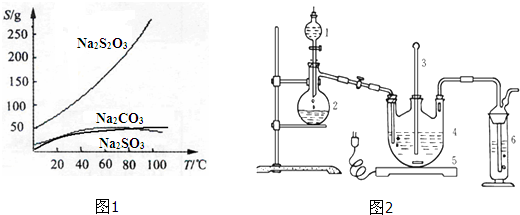

 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答: