
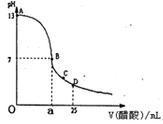
| A、c(H+)=c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、a=12.5 |
| D、a>12.5 |


科目:高中化学 来源: 题型:
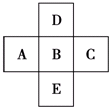 如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物.试回答下列问题(均用具体的元素符号回答):
如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物.试回答下列问题(均用具体的元素符号回答):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当a=8,b=3时,该物质可能发生加成反应 |
| B、无论b值大小.a都不可能为奇数 |
| C、当a=6,b=2时,该物质不可能含有两种官能团 |
| D、当a=6,b=2时,该物质属于酯类物质的同分异构体共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4项 | B、5项 | C、6项 | D、7项 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和④ | B、②和③ |
| C、②③④ | D、只有④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com