
【题目】下列离子方程式书写不正确的是 ( )
A. 等体积、等物质的量浓度的NaHCO3和Ca(OH)2两溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O
B. 向澄清石灰水中通入过量的CO2:OH-+CO2=HCO3-
C. 在含3a mol HNO3的稀溶液中,加入a mol 铁粉:4Fe+12H+ +3NO3-=Fe3++3Fe2++3NO↑+6H2O
D. Al2(SO4)溶液中加入过量氨水:Al3++4NH3H2O=AlO2-+4NH4++2H2O
【答案】D
【解析】
A. 等体积、等物质的量浓度的NaHCO3和Ca(OH)2两溶液混合生成碳酸钙、氢氧化钠和水:HCO3-+Ca2++OH-=CaCO3↓+H2O,A正确;
B. 向澄清石灰水中通入过量的CO2生成碳酸氢钙:OH-+CO2=HCO3-,B正确;
C. 根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,在含3a mol HNO3的稀溶液中加入a mol 铁粉,铁反应后被氧化成亚铁离子和铁离子,硝酸完全反应,设生成铁离子为xmol,生成亚铁离子为ymol,则x+y=a,3x+2y+![]() =3a,解得:x=0.25a、y=0.75a,即反应生成的铁离子与亚铁离子的物质的量之比为1:3,该反应的离子方程式为4Fe+12H+ +3NO3-=Fe3++3Fe2++3NO↑+6H2O,C正确;
=3a,解得:x=0.25a、y=0.75a,即反应生成的铁离子与亚铁离子的物质的量之比为1:3,该反应的离子方程式为4Fe+12H+ +3NO3-=Fe3++3Fe2++3NO↑+6H2O,C正确;
D. Al2(SO4)溶液中加入过量氨水生成氢氧化铝沉淀和硫酸铵,氨水不能溶解氢氧化铝,D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源的宝库:合理利用海水资源是当今是世界研究的重点课题。结合所学知识回答下列问题:
(1)列举一项海水中的能源:__________ ,海水中储量最大的资源是________ ,获得该资源最古老的方法是____________。
(2)海水中还有大量NaCl,MgCl2等盐类物质,从海水中获得纯净NaCl的分离提纯方法有过滤、______。
(3)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
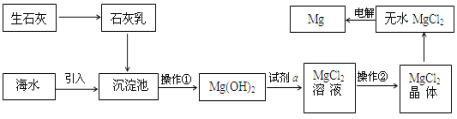
提示: MgCl2晶体的化学式为MgCl26H2O; MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
①操作②的名称___________、冷却结晶、过滤。
②用氯化镁电解生产金属镁的化学方程式为:_____________________。
(4)粗盐提纯后的的卤水中含有大量的溴,从中提取溴的部分过程如下:

实验室模拟上述过程设计以下装置进行实验(所有橡胶制品已被保护,夹持装置已略去)

①A装置中通入a气体的目的是(用离子方程式表示) __________________________________________;
②A装置中先通入a气体后改通热空气。通入热空气的目的是______________________________________;
③B装置中b气体是SO2,目的是吸收富集Br2,此处离子方程式为___________________________________;
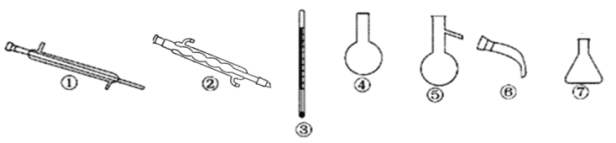
④向B装置中再次通入Cl2得到单质溴,对液体进行蒸馏,收集液溴。蒸馏应该选择下列仪器_____(填序号) 。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到过量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中错误的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100ml
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C. 参加反应的金属的总质量为9.6g>m>3.6g
D. 当金属全部溶解时收集到NO气体的体积在标准状况下一定为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于组成生物体的化学元素,下列叙述不正确的是
A. 组成生物体的化学元素,可以分成大量元素和微量元素
B. 组成不同生物体的化学元素不仅种类大体相同含量也基本相同
C. 组成生物体的化学元素,没有一种是生物界所特有的
D. 组成玉米和家兔的最基本元素都是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是( )
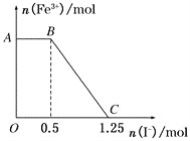
A. 图中AB段主要是高锰酸钾和碘化钾溶液反应
B. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
C. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D. 根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素是生产生活中常见的非金属元素。
(1)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是________和________。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是__________________
(2)已知:2H2O2(l)===2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g)===2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式:________________________________。
(3)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com