
 ��1���£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬������ȼ�ϣ���-����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ����Ӧ����һ�ֿ��Բ������ѭ�������壮�õ�طŵ�ʱ�������ĵ缫��Ӧʽ�ǣ�N2H4+4OH--4e-=4H2O+N2����
��1���£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬������ȼ�ϣ���-����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ����Ӧ����һ�ֿ��Բ������ѭ�������壮�õ�طŵ�ʱ�������ĵ缫��Ӧʽ�ǣ�N2H4+4OH--4e-=4H2O+N2�������� ��1����-��������ȼ�ϵ���У�������ȼ����ʧ���Ӻ����������ӷ�Ӧ����ˮ�͵��������������õ��ӷ�����ԭ��Ӧ��
��2��ʯī�缫�븺������Ϊ�����������������ӵõ��ӣ����ݴ�����·�е����غ���㣮
��� �⣺��1����-��������ȼ�ϵ���У�������ȼ����ʧ���Ӻ����������ӷ�Ӧ����ˮ�͵������缫��ӦʽΪN2H4+4OH--4e-=4H2O+N2��������������ԭ��Ӧ���缫����ʽΪO2+2H2O+4e-=4OH-��
�ʴ�Ϊ��N2H4+4OH--4e-=4H2O+N2����
��2��ʯī�缫�븺������Ϊ�����������������ӵõ��ӣ���缫����ʽΪ��2H++2e-=H2����
H2O2 ��S2O82-��2SO42-��2e-��$\frac{1}{2}$N2H4
1mol 0.5mol
��Ҫ��ȡ1mol H2O2����ȼ�ϵ��������������0.5molN2H4��
�ʴ�Ϊ��2H++2e-=H2����0.5��
���� ���⿼��ԭ��غ͵��صĹ���ԭ��������ʱע�������ϵı仯��Ҫ����д�缫��Ӧʽ���������غ�͵����غ�ĽǶ����⣬��Ŀ�Ѷ��еȣ�


 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ�� pH ������ | B�� | ��Һ�е� c��OH-����С | ||
| C�� | ����ĵ���̶������� | D�� | ��Һ�ĵ���������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ʹʪ�����ɫ������ɫ������Ϊ��������Ư���� | |
| B�� | �ֱ���ʢ��HCl�����ʢ��NO2�������ƿ����Ȫʵ�飬��Ȫ������������Һ�����ʵ���Ũ����ͬ | |
| C�� | ��50 mL 18 mol•L-1 ��H2SO4��Һ�м���������ͭƬ���ȳ�ַ�Ӧ����ԭ��H2SO4�����ʵ�������0.45 mol | |
| D�� | �����£�Ũ��������������������棬˵������Ũ�����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
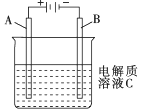
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
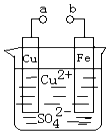
| A�� | a��b������ʱ����Ƭ�ϻ��н���ͭ���� | |
| B�� | a��b�õ�������ʱ����Ƭ�Ϸ����ķ�ӦΪ��Fe-3e-�TFe3+ | |
| C�� | ����a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ | |
| D�� | a��b�õ������Ӻ���Ƭ�Ϸ�����ԭ��Ӧ����Һ��ͭ������ͭ�缫�ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
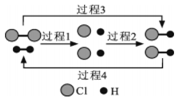 H2 ����Cl2��ȼ������ HCl��HClҲ����һ�������·ֽ�ΪH2��Cl2�� ͼΪH2��Cl2��HCl �����ת�����۹���ʾ��ͼ�������������ȹ��̵��� ��������
H2 ����Cl2��ȼ������ HCl��HClҲ����һ�������·ֽ�ΪH2��Cl2�� ͼΪH2��Cl2��HCl �����ת�����۹���ʾ��ͼ�������������ȹ��̵��� ��������| A�� | ���� 1 | B�� | ���� 2 | C�� | ���� 3 | D�� | ���� 4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com