
许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是 ( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
元素A和B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a﹣2b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )
|
| A. | 能与水反应 | B. | 能与氢氧化钠溶液反应 |
|
| C. | 能与硫酸反应 | D. | 能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
A.化学反应的实质是旧化学键断裂和新化学键的形成
B.所有的化学变化一定遵循质量守恒和能量守恒
C.在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是放热反应
D.化学键的变化必然会引起能量变化,所以能量变化也一定会引起化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。
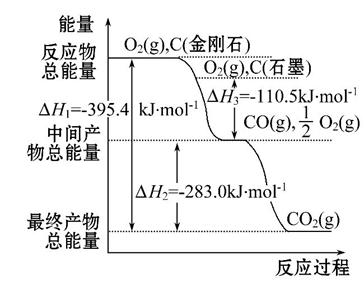
(1)等质量的金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)放出
热量更多,写出表示石墨燃烧热的热化学方程式 。
(2)在通常状况下,金刚石和石墨相比 (填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式 。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和
5.4 mol·L-1,在一定条件下它们反应生成NH3,10 min后测得N2的浓度是
0.8 mol·L-1,则在这10 min内NH3的平均反应速率是( )
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
胶状液氢(主要成分是H2和CH4)有希望用于未来的运载火箭和空间运输系统。实验测得:101 kPa,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A.CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
B.CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ
D.2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3﹢+3H2↑ |
|
| B. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+H﹢=Al3﹢+H2O |
|
| C. | 碳酸氢钠溶液中加入氢氧化钠:HCO3﹣+OH﹣=CO32﹣+H2O |
|
| D. | 碳酸钙与稀硝酸反应:CO32﹣+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烷RX(R是烷基,X是某种卤原子)的密度是a g•cm﹣3.RX可以与稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中.
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应.
③反应完成后,冷却溶液,加稀硝酸酸化,滴加过量AgNO3溶液得到白色沉淀.
④将沉淀过滤、洗涤、干燥后称重,得到固体c g.
回答下列问题:
(1)装置中长玻璃管的作用是 .
(2)该卤代烷中所含卤素的名称是 ,判断依据是 .
(3)如R为乙基,则RX与KOH醇溶液反应的方程式为:
(4)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④测得的c值
A.偏大 B.偏小 C.不变 D.大小不定.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com