
 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.分析 由信息可知,该反应中氧化剂是KBrO3,还原剂是AsH3,溴元素化合价变化为由+5价降低,As元素化合价变化为-3→+5价,
(1)化合价升高元素所在的反应物是还原剂;
(2)根据溴元素化合价的降低情况来计算;
(3)根据氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此判断;
(4)根据化合价的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数;
(5)a.KMnO4具有氧化性H2C2O4具有还原性,两者能发生氧化还原反应,据此书写离子方程式;
b.次氯酸根离子具有氧化性,可以将氢氰根离子氧化,在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体氮气,原理方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
c.通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
解答 解:(1)KBrO3在反应中得到电子,所以KBrO3化合价降低是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂,
故答案为:AsH3;
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2,
故答案为:Br2;
(3)a、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故a正确,b错误;
c、AsH3是还原剂,X是还原产物,所以还原性AsH3>X,故c正确,故d错误.
故选:ac;
(4)KBrO3在反应中得到电子,AsH3具失去电子,转移的电子数为40e-,则标出电子转移的方向和数目为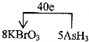 ,故答案为:
,故答案为: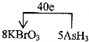 ;
;
(5)a.KMnO4具有氧化性H2C2O4具有还原性,两者能发生氧化还原反应,故离子方程式为2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
b.次氯酸根离子具有氧化性,可以将氢氰根离子氧化,在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体氮气,原理方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,故答案为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
c.装有5.0mL 1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,故I元素在氧化产物中的化合价为$\frac{5.0×1{0}^{-2}mol}{0.005L×1.0mol/L}$=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;
故答案为:5Cl2+I2+6H2O=10HCl+2HIO3.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 小于100 mL | B. | 等于100 mL | C. | 大于100 mL | D. | 等于100/ρ mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子数为3 | B. | 相对原子质量为2 | ||
| C. | 原子的核电荷数为3 | D. | 原子结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1molNa+ | |
| B. | 将142g Na2SO4溶于少量水后再稀释到 100mL | |
| C. | 1 mol Na2SO4溶于1 L蒸馏水中 | |
| D. | 1 L溶液中含有142 g Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用萃取的方法提取碘水中的碘 | |
| D. | 用结晶的方法分离氯化钠和硝酸钾的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).
,能说明O元素比N元素为非金属强的是氧气与氢气化合更容易,生成的水比氨气更稳定,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+(用离子符号表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com