
【题目】W、X、Y、Z、T均为短周期元素,X、Y、T原子最外层电子数之和为18。下列说法正确的是
![]()
A.X、Y、T三种元素最低价氢化物的沸点依次升高
B.X、Y和氢三种元素可共同形成离子化合物或共价化合物
C.物质WY2、ZY2一定都有熔点高、硬度大的特性
D.元素X、Y、T的最高正价的顺序为:T>Y>X
【答案】B
【解析】
五种元素W、X、Y、T、Z均为短周期元素,设X最外层电子数为a,则Y、T最外层电子数依次为a+1、a+2,X、Y、T原子最外层电子数之和为18,则3a+3=18,解得a=5,故W为C、Z为Si、X为N、Y为O、T为Cl元素,据此分析。
五种元素W、X、Y、T、Z均为短周期元素,设X最外层电子数为a,则Y、T最外层电子数依次为a+1、a+2,X、Y、T原子最外层电子数之和为18,则3a+3=18,解得a=5,故W为C、Z为Si、X为N、Y为O、Z为Cl元素。
A. X、Y、T三种元素最低价氢化物NH3、H2O、SiH4的沸点比较中H2O最高,因为水分子间存在氢键,选项A错误;
B. X、Y和氢三种元素可共同形成离子化合物NH4NO3或共价化合物HNO3等,选项B正确;
C. 物质WY2即(CO2)为分子晶体 ,熔点低、硬度小,选项C错误;
D. 元素X、T的最高正价分别为+5、+4,Y没有最高正价,选项D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】室温下的四种溶液:①pH=9的 NaOH 溶液 ②pH=9的CH3COONa溶液 ③pH=5的H2SO4溶液 ④pH=5的NaHSO4 溶液,溶液中由水电离产生的c(OH-)相同的是( )
A.①②B.①③C.③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
⑴钙原子基态时的电子排布式为____________________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是____。
⑵氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___位;写出与NO3-互为等电子体的一种非极性分子的化学式__________。
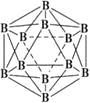
⑶晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有_____________种不同的结构类型。己知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因______________。硼酸的结构与石墨相似,层内的分子以氢键相连,含1 mol硼酸的晶体中有___mol氢键。
⑷硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是_______________。
⑸在浓的TiCl3的盐酸溶液中加入乙醚,并通入HC1至饱和,可得到配位数为6,组成为 TiCl36H2O的晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为:__________________。
⑹钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为a nm,密度为ρ gcm-3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量来确定有机物组成。
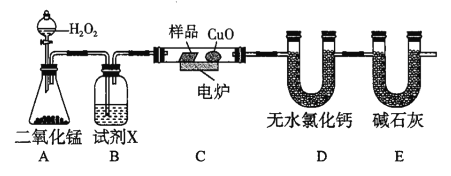
请回答下列问题:
(1)A装置是提供实验所需的O2,写出有关反应的化学方程式__________;B装置中试剂X可选用_________。
(2)若准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),充分反应后,D管质量增加0.36g,E管质量增加0.88g,则该有机物的实验式为________。
(3)要确定该有机物的分子式,还需知道该有机物的_____________,经测定其蒸气密度是相同条件下H2的22倍,则其分子式为___________。
(4)若该有机物的核磁共振氢谱如图所示,则其结构简式为_____________;
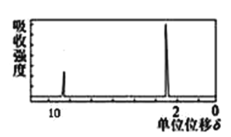
若该有机物只有一种化学环境的氢原子,则其结构简式为___________。
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个E装置,其主要目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)
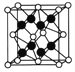
(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式_____________________________。
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是_______________________。
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式_______________________。
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
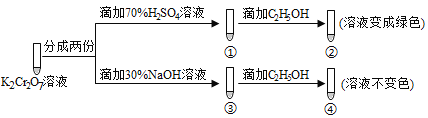
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com