
| A、N2、H2和NH3的物质的量分数不再改变 |
| B、c(N2):c(H2):c(NH3)=1:3:2 |
| C、单位时间每增加1molN2,同时增加2mol NH3 |
| D、N2与H2的物质的量之和是NH3的2倍 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
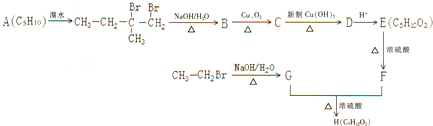
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
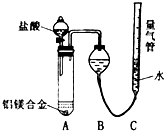 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.| NaOH溶液 |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,物质的量之比n(A):n(B):n(C)=2:11:4 |
| B、x值等于3 |
| C、A的转化率为20% |
| D、B的平均反应速率为0.4 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
| B、一次电池是最常见的化学电源,一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用,铅蓄电池是最常见的一次电池 |
| C、氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| D、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com