
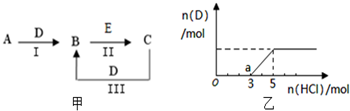
 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示
| ||
| ||
| 5mol |
| 2L |


科目:高中化学 来源: 题型:
| A、D2O中质子数与中子数 |
| B、Na2O2中的阴,阳离子数 |
| C、SO2与氯水反应生成两种强酸的反应中,氧化剂与还原剂 |
| D、沸水时纯水中H+与OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: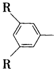 ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应①是加成反应 |
| B、反应②是加聚反应 |
| C、反应③是消去反应 |
| D、反应④⑤⑥是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、芳香烃主要来源于分馏煤焦油和石油的催化重整 |
| B、苯的同系物均可被酸性高锰酸钾溶液氧化 |
| C、含苯环的烃都是芳香烃 |
| D、用分子筛固体催化剂工艺生产乙苯,可大幅度降低对环境的污染,提高环境效益 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com