
| A. | ① | B. | ② | C. | ③ | D. | ④ |
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:填空题
①分离饱和食盐水与沙子的混合物 | ②分离水和汽油的混合物 | ③分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物,CCl4和甲苯互溶 | ④提取出碘水中的碘单质 |
| D | B | C | A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
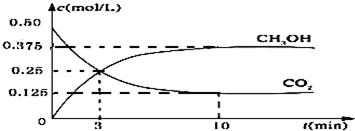
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 向KHSO4溶液中加入Ba(OH)2溶液至恰好沉淀完全:Ba2++H++SO42-+OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室常用排饱和食盐水的方法收集氯气 | |
| B. | 工业合成氨控制温度在较高温度(500℃)进行 | |
| C. | 在浓氨水中加入烧碱可用于实验室快速生氨 | |
| D. | 工业上将二氧化硫转化为三氧化硫常通入过量空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com