
【题目】硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
FeS2 ![]() SO2
SO2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
回答下列问题:
(1)基态V原子的电子排布式为________,基态Fe原子核外未成对电子数为______。
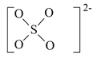
(2)组成H2SO4的元素中,电负性由大到小的顺序是________,SO2分子的VSEPR模型为________。
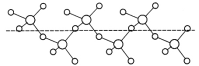
(3)固态SO3能以无限长链形式存在(如图所示)。其中S原子的杂化形式为______。长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是________(填“桥氧”或“端基氧”),原因是______________。
(4)绿矾是一种重要的硫酸盐,其组成可写成[Fe(H2O)6]2+[SO4(H2O)]2-,水合阴离子中H2O通过氢键与SO42-中的O原子相联结,按图示画出含氢键的水合阴离子:______________。
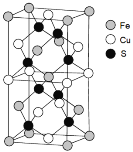
(5)一种含Fe、Cu、S三种元素的矿物晶胞如图所示,属于四方晶系(晶胞底面为正方形)。S2-的配位数为______。若晶胞的底面边长为a pm,高为b pm,晶体密度为ρ g/cm3,则阿伏加德罗常数可表示为____________(写出表达式)。
【答案】[Ar]3d34s2 4 O>S>H 平面三角形 sp3 桥氧 端基氧与硫原子形成双键,桥氧为硫氧单键,硫氧单键键长比硫氧双键大  4
4 ![]()
【解析】
(1)V原子为23号元素,基态原子核外有23个电子,所以电子排布式为:[Ar]3d34s2;基态Fe原子核外电子排布式为1s22s22p63s23p63d64s2,3d轨道有4个电子未成对;
(2)非金属性越强,电负性越大,所以H、S、O三种元素电负性由大到小为O>S>H;二氧化硫分子中心原子价层电子对数为![]() =3,所以为sp2杂化,其VSEPR模型为平面三角形;
=3,所以为sp2杂化,其VSEPR模型为平面三角形;
(3)根据固体SO3的结构可知每个S原子形成4个σ键,价层电子对数为4,所以为sp3杂化;端基氧与硫原子形成双键,桥氧为硫氧单键,硫氧单键键长比硫氧双键大,所以桥氧化学键键长更大;
(4)氢键结合的情况可用X-H…Y表示,所以含氢键的水合阴离子为 ;
;
(5)根据晶胞示意图可知S2-连接两个亚铁离子和两个铜离子,所以S2-的配位数为4;根据均摊法晶胞中S2-的个数为8,Fe2+的个数为![]() ,Cu2+个数为
,Cu2+个数为![]() =4,所以晶胞的质量m=
=4,所以晶胞的质量m=![]() ,晶胞体积V=a2b pm3= a2b×10-30 cm3,所以晶胞的密度ρ=
,晶胞体积V=a2b pm3= a2b×10-30 cm3,所以晶胞的密度ρ= ,可解得NA=
,可解得NA=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A. ①② B. ④ C. ③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
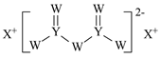
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
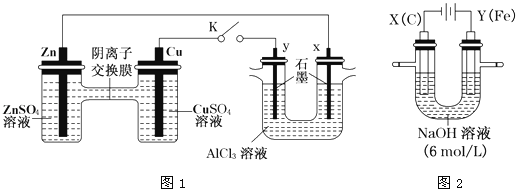
请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为________极;实验过程中,SO42-____________(填“从左向右”、“从右向左”或“不”)移动。
(2)反应初期,y极的电极反应现象为________________;检验y极反应产物的方法是________________。
(3)Cu极的电极反应式为____________。
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为__________。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中,正确的是( )
A.有单质参加的反应一定是氧化还原反应
B.燃烧反应必须有氧气作氧化剂
C.2Fe+3Cl2![]() 2FeCl3; Fe+S
2FeCl3; Fe+S![]() FeS 由此可以判断氧化性:Cl2>S
FeS 由此可以判断氧化性:Cl2>S
D.Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种原子序数依次增大的短周期元素,W、X两种元索可组成W2x和W2X2两种常见的无色液体化合物, Y2X2为淡黄色固体化合物,Z的原子序数是X的原子序数的两倍。请回答下列问题:
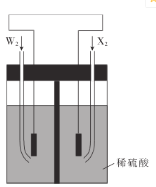
(1)Z元素的名称是___________ 。
(2)W、X、Y三种元素形成的化合物的电子式_____________
(3)写出Y2X2中所含化学键有:___________。
(4)写出Y2X2和W2X反应的化学方程式:_______________
(5)W2和X2是组成某种燃料电池的两种常见物质,如图所示,通人X2的电极是___(填“正极”或“负极”),写出通人W2的电极的电极反应式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mLB.120mLC.240mLD.360mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com