
有Na2SO4 和 Fe2(SO4)3 的混合溶液,已知其中 Fe3+的物质的量浓度为0.4 mol/L,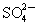 的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为
的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为
A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L
科目:高中化学 来源: 题型:
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
1 L某混合溶液中可能含有的离子如下表:
| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 | Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
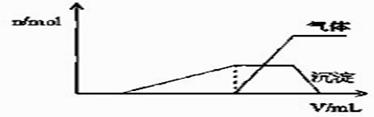
①则该溶液中确定含有的离子有 ; ②不能确定是否含有的阳离子有 , ③要确定其存在可补充做的实验是 ; ④肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的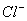 、
、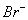 、
、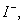 若向1 L该混合溶液中通入一定量的
若向1 L该混合溶液中通入一定量的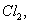 溶液中
溶液中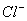 、
、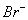 、
、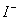 的物质的量与通入
的物质的量与通入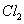 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积 (标准状况) | 2.8 L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入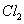 的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中
的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中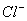 、
、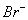 、
、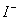 的物质的量浓度之比为 。
的物质的量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有HCO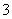 、CO
、CO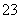 、SO
、SO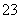 、Na+、NO
、Na+、NO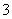 五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计),
五种离子。若向其中加入Na2O2粉末充分反应后(溶液体积变化忽略不计), 溶液中离子浓度保持不变的是
溶液中离子浓度保持不变的是
A.NO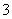 B.CO
B.CO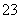 、NO
、NO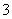
C.SO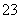 、NO
、NO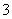 D.CO
D.CO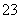 、NO
、NO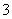 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
家用管道煤气的主要成分是CO、H2、CH4,取1 L管道煤气充分燃烧需要同温同压下的空气5 L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能
A.1∶1∶1 B.1∶1∶2 C.2∶4∶3 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
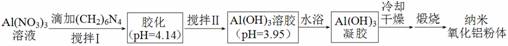
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
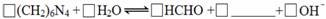
②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化: 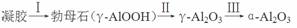 。
。
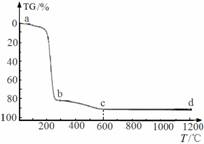 煅烧过程中样品的失重率(TG%)随温度变化
煅烧过程中样品的失重率(TG%)随温度变化
如图。凝胶煅烧失重曲线有明显的三个阶段:
(ⅰ)a~b段:失重率82.12%;
(ⅱ)b~c段:失重率9.37%;
(ⅲ)c~d段:失重率几乎为0。
转化Ⅱ对应的失重阶段是 (填序号ⅰ、ⅱ、ⅲ),转化Ⅲ开始的温度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L恒容密闭容器中发生反应:2N2O5(g)  4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图73所示,下列说法正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图73所示,下列说法正确的是( )
A.10 min时,反应达到平衡
B.达到平衡时N2O5的转化率为60%
C.0~20 min内平均反应速率v(N2O5)=0.05 mol·L-1·min-1
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com