
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |
分析 A、酸性氧化物是指能和碱反应生成盐和水的氧化物;
B、离子化合物是含有离子键的化合物;
C、弱碱属于弱电解质,弱电解质是指水溶液中不能完全电离的化合物;
D、由不同分子构成的物质属于混合物.
解答 解:A、SiO2、P2O5均为酸性氧化,NO和碱之间不反应,不属于酸性氧化物,故A错误;
B、NaH、NaBH4、NaClO均为阳离子和阴离子组成的化合物,含有离子键,属于离子化合物,故B正确;
C、NH3.H2O是弱碱,为弱电解质,但是NH4NO3为盐,属于强电解质,故C错误;
D、液氨为氨气的液态形式,属于纯净物,故D错误.
故选B.
点评 本题考查学生物质的分类知识,注意概念的理解和应用是关键,难度中等.


科目:高中化学 来源: 题型:填空题
 某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| B. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/LNaOH恰好反应 | |
| C. | 达平衡后,减小Si的量,有利于平衡正向移动 | |
| D. | 达平衡后,增大压强,可提高SiCl4的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O=4OH-+O2↑ | |
| C. | 用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH- | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ①中的物质 | ②中的物质 | ③中的物质 | ③中的现象 | 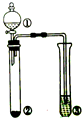 |
| A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
| B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
| C | 浓硫酸 | Na2SO3 | Ba(NO3)2溶液 | 无沉淀生成 | |
| D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
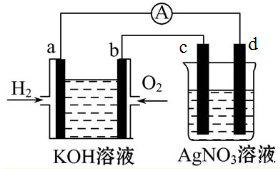
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com