
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)若反应在830℃下达到平衡,该反应平衡常数K=1.0,该反应中各物质计量数相等且反应前后气体计量数之和不变,该反应化学平衡常数也等于平衡时生成物物质的量之积与反应物物质的量之积的比,
设参加反应的二氧化碳物质的量为xmol,
CO2(g)+H2(g)?CO(g)+H2O(g),
开始(mol)2 1 0 0
反应(mol)x x x x
平衡(mol)2-x 1-x x x
化学平衡常数K=$\frac{x.x}{(2-x).(1-x)}$=1.0,
x=$\frac{2}{3}$,二氧化碳转化率=$\frac{参加反应的二氧化碳物质的量}{二氧化碳总物质的量}$×100%;
(3)根据表中数据知,升高温度,平衡常数增大,则该反应的正反应是吸热反应;若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,说明平衡正向移动;
(4)温度不变,化学平衡常数不变,根据浓度商与化学平衡常数相对大小确定反应方向,从而确定正逆反应速率相对大小.
解答 解:(1)化学平衡常数K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$,
故答案为:$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$;
(2)若反应在830℃下达到平衡,该反应平衡常数K=1.0,该反应中各物质计量数相等且反应前后气体计量数之和不变,该反应化学平衡常数也等于平衡时生成物物质的量之积与反应物物质的量之积的比,
设参加反应的二氧化碳物质的量为xmol,
CO2(g)+H2(g)?CO(g)+H2O(g),
开始(mol)2 1 0 0
反应(mol)x x x x
平衡(mol)2-x 1-x x x
化学平衡常数K=$\frac{x.x}{(2-x).(1-x)}$=1.0,
x=$\frac{2}{3}$,二氧化碳转化率=$\frac{参加反应的二氧化碳物质的量}{二氧化碳总物质的量}$×100%=$\frac{\frac{2}{3}mol}{2mol}$=$\frac{1}{3}$,
故答案为:$\frac{1}{3}$;
(3)根据表中数据知,升高温度,平衡常数增大,则该反应的正反应是吸热反应;若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,说明平衡正向移动,则容器内温度升高,故答案为:升高;
(4)温度不变,化学平衡常数不变,加入1mol CO2 和1molCO后浓度商=$\frac{(\frac{2}{3}+1).\frac{2}{3}}{(3-\frac{2}{3})(1-\frac{2}{3})}$=$\frac{10}{7}$>1,则平衡向逆反应方向移动,反应速率v正小于 v逆,故答案为:小于;逆.
点评 本题考查化学平衡有关计算,为高频考点,把握三段式解题方法是解本题关键,难点是(4)题判断平衡移动方向,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+ | B. | 还原性:Br->Cl- | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 酸性:H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②不对 | B. | ③④不对 | C. | ①④不对 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
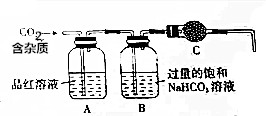 实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:
实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up是两种元素 | |
| B. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up互为同位素 | |
| C. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up质子数不同、中子数相同 | |
| D. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up质量数相同、电子数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com