
| A. |  | B. |  | C. |  | D. | 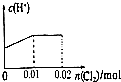 |
分析 根据方程式知,还原性H2SO3>HBr,所以向混合溶液中通入氯气时,先氧化H2SO3后氧化HBr,根据方程式H2SO3+Cl2+H2O═2HCl+H2SO4知,0.01mol H2SO3完全被氧化,需要n(Cl2)=n(H2SO3)=0.01mol,
亚硫酸是弱酸、盐酸和硫酸都是强酸,所以随着反应的进行氢离子浓度增大;
剩余的0.01mol氯气氧化HBr,根据Cl2+2HBr=Br2+2HCl知,0.01mol氯气能氧化0.02molHBr,HCl、HBr都是强电解质,溶液中c(H+)不变.
解答 解:根据方程式知,还原性H2SO3>HBr,所以向混合溶液中通入氯气时,先氧化H2SO3后氧化HBr,根据方程式H2SO3+Cl2+H2O═2HCl+H2SO4知,0.01mol H2SO3完全被氧化,需要n(Cl2)=n(H2SO3)=0.01mol,亚硫酸是弱酸、盐酸和硫酸都是强酸,所以随着反应的进行氢离子浓度增大;
剩余的0.01mol氯气氧化HBr,根据Cl2+2HBr=Br2+2HCl知,0.01mol氯气能氧化0.02molHBr,HCl、HBr都是强电解质,所以该过程中氢离子浓度不变,即横坐标增大而纵坐标不变,
故选D.
点评 本题以物质之间的反应为载体考查氧化还原反应的计算、强弱电解质等知识点,明确方程式中各个物理量之间的关系是解本题关键,注意氯气和HBr反应时氢离子浓度不变,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,立即用沾水的毛巾覆盖 | |
| B. | 将含有硫酸的废液倒人水池,用大量水冲人下水道 | |
| C. | 锌和稀硫酸反应生成的氢气可直接点燃,观察火焰的颜色 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 铁器(植物油) | 热纯碱溶液 | 洗涤 |
| B | BaCO3(BaSO${\;}_{{4}_{\;}}$) | 饱和碳酸钠溶液 | 搅拌、过滤 |
| C | KNO3(NaCl) | 水 | 蒸发结晶 |
| D | HCl(Cl2) | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | Na2O2与CO2反应生成11.2LO2(标准状况),反应中转移的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含的氧原子数目为3NA | |
| D. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是( )| 选项 | X | Y | Z |
| A | Mg | MgO | MgCl2 |
| B | Fe | FeCl3 | FeCl2 |
| C | Na2CO3 | NaOH | NaHCO3 |
| D | Cl2 | Ca(ClO)2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,反应后c(Cl-):c(ClO-)=6,则溶液中c(ClO-):c(ClO3-)=1 | |
| B. | 参加反应的氯气的物质的量等于0.5amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$amol<n<$\frac{5}{6}$amol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{6}$amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱销技术”,减少硫的氧化物和氮的氧化物污染 | |
| B. | 禁止未经处理的工业废水和生活污水的任意排放 | |
| C. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 大量使用化肥农药,提高粮食产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
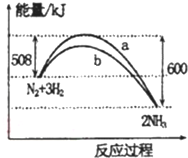
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92KJ/mol | |
| B. | a曲线是加人催化剂时的能量变化曲线 | |
| C. | 加人催化剂,该化学反应的放热减少 | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com