
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:

(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
【答案】(NH4)2SO3 (NH4)2SO4 SO2 NH3 K2SO3 K2SO4 K2SO3+Br2+H2O=K2SO4+2HBr F中的阴离子是硫酸根离子,可以加入盐酸、氯化钡溶液看是否产生沉淀来鉴别
【解析】
根据框图可知,A即与酸反应生成气体C,又与碱反应生成气体D,则A为弱酸弱碱盐;C与氨水生成A,D与C的溶液反应生成A,则D为NH3,A为铵盐;A的浓溶液与稀H2SO4反应生成B和C,则B是(NH4)2SO4,F为K2SO4;A的浓溶液与KOH溶液反应生成E和D,E和溴水反应生成K2SO4,则E为K2SO3、C为SO2、A为(NH4)2SO3。
(1)由以上分析可知,A为(NH4)2SO3、B为(NH4)2SO4、C为SO2、D为NH3、E为K2SO3、F为K2SO4;
(2)E→F的反应为K2SO3溶液与溴水发生氧化还原反应生成硫酸钾和氢溴酸,反应的化学方程式为K2SO3+Br2+H2O=K2SO4+2HBr;
(3)F为K2SO4,阴离子为SO42-,可用酸化的BaCl2检验SO42-,具体操作是取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,一中鼹鼠科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其他分散系的本质区别是:__。
(2)制备时,将_逐滴滴加至_中,待液体呈_后,停止加热;反应方程式为__。
(3)有一种橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,这叫__现象,证明Sb2S3胶粒带__电荷。
(4)如何设计实验验证制得的氢氧化铁是胶体:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
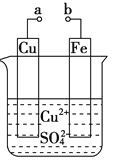
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
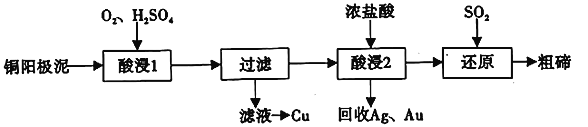
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
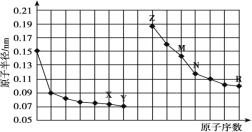
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com