
����Ŀ���ִ�����п�����з���������������Ҫ��Ӧ������˵����ȷ����
�� 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) ��H1=a kJ mol-1
�� 2C(s) +O2(g)=2CO(g) ��H2=b kJ mol-1
�� ZnO(s) +CO(g)=Zn(g) +CO2(g) ��H3=c kJ mol-1
A. ����������Ӧ�У�ֻ�Т��Ƿ��ȷ�Ӧ
B. ��Ӧ�ڵ������ǽ�Ϊ��Ӧ���ṩ��ԭ��
C. �����ַ����õ����Ǵ�����п����
D. ��ӦZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)����H=![]() kJ mol-1
kJ mol-1
���𰸡�D
��������
A��ȼ�շ�ӦΪ���ȷ�Ӧ����٢�Ϊ���ȷ�Ӧ����A����
B����Ӧ�ڷ��ȣ���������û���Ϊ��Ӧ���ṩ��������B����
C�����뷴Ӧ�Ĺ�����ZnS��ZnO��C��Zn�����������ַ��������ܵõ��Ĵ�����п���ʣ���C����
D����֪��
�� 2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) ��H1=a kJmol-1
�� 2C(s)+O2(g)=2CO(g) ��H2=b kJmol-1
�� ZnO(s)+CO(g)=Zn(g)+CO2(g) ��H3=c kJmol-1
��ϸ�˹���ɿ�֪(��+��)/2+�۵÷���ʽZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)�����H=(a+b+2c)/2 kJmol-1����D��ȷ��
��ѡD��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�Ϻ������Դ���о���������������������Ҫ���塣
��ش�
(1)��֪һ�������·������·�Ӧ��
CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) ��H=+802kJ��mol��1��
CH4(g)+2O2(g) ��H=+802kJ��mol��1��
��һ������CO2(g)��H2O(g)����10L�ܱ������У��ֱ��ڴ���M��N�������·���������Ӧ��CH4(g)�IJ���(n)�����ʱ��(t)���¶�(T)�仯�Ĺ�ϵ��ͼ1��ʾ��
���������ȼ����(��H)Ϊ��890kJ��mol��1����ˮ�������ȡ�H=___________��(������ָ1molҺ��ת��Ϊ����ʱ���յ�����)
��T1�桢����M�����£�0~20h�ڸ÷�Ӧ����v(H2O)=___________��

�۸���ͼ1�жϣ�T1___________T2(�������������=��)������Ϊ___________��
�����Ĵ�Ч����M___________N(�ǿ�ڡ������ڡ�)��
(2)����������Ʊ��ϳ�����CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H����CH4(g)��H2O(g)�����ʵ���֮��Ϊ1��3����ʢ�д����ĸ��������з����÷�Ӧ����ͬʱ����ڲ��CO���������(
CO(g)+3H2(g) ��H����CH4(g)��H2O(g)�����ʵ���֮��Ϊ1��3����ʢ�д����ĸ��������з����÷�Ӧ����ͬʱ����ڲ��CO���������(![]() )���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
)���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��
��T0��ʱ��CO�������������ԭ��Ϊ_________________________________��
����T0��ʱ����������ʼѹǿΪp0��CO��ƽ���������Ϊ10%����Ӧ��ƽ�ⳣ��Kp=___________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں������������֮�佨����ϵ���ǻ�ѧѧ�����е�˼ά��ʽ������β������ɴ�����Ⱦ����Ҫԭ��֮һ���������������ϰ�װ����ת�����������ʹ������β��ת���������塣��������ʾ̼ԭ�ӣ�������ʾ��ԭ�ӣ���![]() ��ʾ��ԭ�ӣ���ͼΪ����ת�����۹��̡��������ͼʾ�ش��������⣺
��ʾ��ԭ�ӣ���ͼΪ����ת�����۹��̡��������ͼʾ�ش��������⣺

��1��A��B��C�������ʿ��Թ�Ϊһ���������_______________________________��
��2����C��Ϊ�������D��Ϊ���ʵ�������_______________________________��
��3���û�ѧ��Ӧ����ʽ��ʾΪ________________________________��
��ѧ�仯���������ĵ�A���ʺ����ɵ�C���ʵ�������Ϊ________��
��4�����۵ĽǶ�ȥ�������õĹ��ڻ�ѧ�仯���й���Ϣ(���һ������)____________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������
��Ѫ֬��һ�ֳ�������Ѫ�ܼ��������Ƹ�Ѫ֬����ҩI�ĺϳ�·�����£�
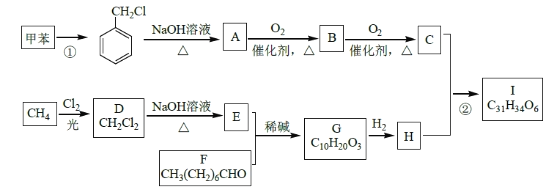

�ش��������⣺
��1����Ӧ�������Լ��������ֱ���____________��F �Ļ�ѧ����Ϊ____________��
��2�����ķ�Ӧ������______________��A��B �Ļ�ѧ����ʽΪ_____________________��
��3��G �Ľṹ��ʽΪ______________��H �����������ŵ�������____________��
��4��������W����Է��������Ȼ�����C��14������������������W�Ŀ��ܽṹ��___�֡�
����FeCl3 ��Һ����ɫ �����ڷ����廯���� ���ܷ���������Ӧ���к˴Ź���������ʾ��5 �ֲ�ͬ��ѧ�������⣬�������Ϊ2:2:2:1:1��д������Ҫ���W �Ľṹ��ʽ____________��
��5������üױ�����ȩΪԭ���Ʊ�![]() �ĺϳ�·�ߣ��������Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪ��
�ĺϳ�·�ߣ��������Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪ��![]() ��____________��
��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣩����(��Ҫ��Ⱦ��SO2��NO��NO2)�Ĵ����ŷ�������صĴ�����Ⱦ�����ڽ����о��ɹ��Dz���������Ϊ��ԭ������������һ�廯������
(1)�����ܷ�Ӧ��SO2(g)��CO(NH2)2(aq)��2H2O(l)��1/2O2(g)��(NH2)SO4(aq)��CO2(g)����֪�÷�Ӧ���Է����У���������____(�������������������������κ��¶���)��
(2)���ϡ�����Ʊ�O3(ԭ����ͼ)�������O3�ĵ缫��ӦʽΪ______��


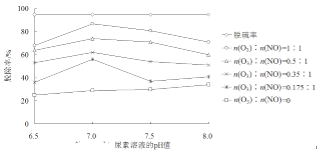
(3)�����£������ݵķ�Ӧ���м���̶����ʵ�����SO2��NO��ͨ��O3��ֻ�ϡ���Ӧ��ͬʱ�����ֵ����ʵ�����n(O3)��n(NO)�ı仯����ͼ��
�� n(NO2)��n(O3)��n(NO)�ı仯�����Ӻ���٣�ԭ����____��
�� �������Է�ӦSO2(g)��O3(g)��SO3(g)��O2(g)��Ӱ�첻�����ù���̬���۽��Ϳ���ԭ��__��
(4)ͨ�����Ʊ������о��ѳ�Ч�ʵ�Ӱ�����صõ���������ͼ��ʾ������˵����ȷ����____��
A. ������������Һ�еķ�Ӧ��v(����)��v(����)
B. ������ҺpH�ı仯������Ч�ʵ�Ӱ����ڶ�����Ч�ʵ�Ӱ��
C. ǿ���������²��������ضԵ���������ѳ�
D. pH=7��������Һ����Ч�����

(5)���ص��Ʊ���2NH3(g)��CO2(g)![]() CO(NH2)2(s)��H2O(g) ��H��0��һ�������£���10 L�����ܱ������г���2 mol NH3��1 mol CO2��
CO(NH2)2(s)��H2O(g) ��H��0��һ�������£���10 L�����ܱ������г���2 mol NH3��1 mol CO2��
�� �÷�Ӧ10 min ��ﵽƽ�⣬��������������ܶ�Ϊ4.8 g��L��1��ƽ�ⳣ��K=__��

�� ��ͼ�Ǹ������£�ϵͳ�����ص����ʵ����淴Ӧʱ��ı仯���ƣ�����Ӧʱ��ﵽ3min ʱ��Ѹ�ٽ���ϵ���£�����ͼ�л���3~10 min �����������ص����ʵ����ı仯��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��RΪ���ֶ���������Ԫ�أ�Y��Z��W��ԭ������������ͬ��������Ԫ�أ�������������֮��Ϊ15��X��Y������һ�����Ӳ㣻R����������X��Y��Z��W����Ԫ��������֮�͵�![]() ������˵����ȷ���ǣ� ��
������˵����ȷ���ǣ� ��
A. �����Ӱ뾶��![]()
B. X��Y�γɵĶ�Ԫ�����ﳣ����һ��Ϊ��̬
C. W��R�γɵĻ����������ӻ�����
D. Y��W��Z��W�γɵĶ�Ԫ�����ﶼ�Ǵ�����Ⱦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ӧ�ķ���ʽ�����ϵ���
A. ��Ȼ������������ˮ�����ԣ�H2O��CO2![]() H2CO3 ��H2CO3
H2CO3 ��H2CO3![]() H+��HCO3��
H+��HCO3��
B. ��NO2������������ˮ�У���ɫ��dz��2NO2��g�� ������ɫ��![]() N2O4 ��g�� ����ɫ�� ��H��0
N2O4 ��g�� ����ɫ�� ��H��0
C. �����ȼ����Ϊ��890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g����2O2��g����CO2��g��+2H2O��g�� ��H����890.3 kJ��mol-1
D. �����������Һ��ϡ�����ϳ��ֻ�����S2O32-��2H+��S ��SO2 ��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ���������NOx�������γ�������Ⱦ��������ͨ�����ֻ�ѧ�������������������������ش��������⣺
��1�������������£�������ӦΪ��6NO��g��+4NH3��g��5N2��g��+6H2O��g����H=-1807.0kJmol-1��T��ʱ���ں��ݵ��ܱ������У�����ڲ�ͬʱ��NO��NH3�����ʵ������±���
ʱ��/min | 0 | 1 | 2 | 3 | 4 |
n��NO��/mol | 1.20 | 0.90 | 0.72 | 0.60 | 0.60 |
n��NH3��/mol | 0.90 | 0.70 | 0.58 | 0.50 | 0.50 |
������˵����ȷ����______������ţ���
A��3min��NO��NH3��Ũ�ȶ����ٱ仯����Ӧֹͣ����
B��ǰ2min�ڵ�ƽ����Ӧ����v��N2��=0.20molL-1min-1
C���ﵽƽ��ʱNO��ת����Ϊ50%
D����ʱ�����N2����ʹ�÷�Ӧ�ķ�Ӧ��������ƽ�������ƶ�
������Ӧ��ʼ��ѹǿΪp0����÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=______�����÷�����ʾ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��2�������������£�NOxҲ�ܷ���������Ӧ��
����֪��N2��g��+O2��g��=2NO��g����H=180.6kJmol-1
N2��g��+3H2��g��2NH3��g����H=-92.4kJmol-1
H2O��g��=H2��g��+![]() O2��g����H=241.8kJmol-1
O2��g����H=241.8kJmol-1
��������Ӧ4NO��g��+4NH3��g��+O2��g��=4N2��g��+6H2O��g����H=______kJmol-1
�ڳ������������������������������ӦΪ2NO2��g��+O3��g��N2O5��g��+O2��g����H��0����Ӧ�ں����ܱ������н��У�NO2�İٷֺ�����ѹǿ��p����x�ı仯��ͼ��ʾ��
��p1______p2��������������������=������x��ʾ����������ʱ���⣬��������______��
��3�����ö��Ե缫���Ҳ�ܶ����������������������ԭ����ͼ��ʾ��

�缫a�ĵ缫��ӦʽΪ______�������44.8L����״������5%NO�������������ϵ�·��ͨ�����ӵ����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ������˵����ȷ���ǣ� ��

A. ״̬1��Һ̬����״̬3һ������̬
B. ״̬3��Һ̬����״̬4һ������̬
C. A��״̬2��+B��g���TC��״̬3��+D��g����H����d��a��kJmol��1
D. ����1molC��״̬3����1molD��g���еĻ�ѧ����Ҫ���յ�����Ϊ��e��d��kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com