
【题目】下列叙述及解释正确的是
A.2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
D.FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:
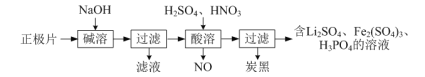
①写出“碱溶”时的离子方程式:________。
②写出“酸溶”时的化学方程式:________。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________。
(2)羟基自由基(电子式为![]() ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
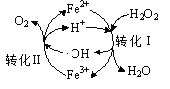
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某![]() 样品中含有
样品中含有![]() 和
和![]() 杂质,现欲制取纯净的
杂质,现欲制取纯净的![]() ,某同学设计如图的实验方案。请回答下列问题:
,某同学设计如图的实验方案。请回答下列问题:

(1)操作Ⅰ的名称是______,在该操作中用到的玻璃仪器除了有烧杯、玻璃棒,还有______
(2)沉淀A的成分是______![]() 填化学式
填化学式![]() ,写出第③步反应中铝元素转化的离子方程式______
,写出第③步反应中铝元素转化的离子方程式______
(3)写出证明滤液B中![]() 已沉淀完全的实验方法______
已沉淀完全的实验方法______
(4)不改变上述流程图的结构,将“①过量盐酸”“②过量NaOH”交换位置,则“③过量![]() ”应改为_____,写出此方案下生成沉淀B的离子方程式______
”应改为_____,写出此方案下生成沉淀B的离子方程式______
(5)为了得到更加纯净的![]() ,过滤后需要进行操作步骤是______
,过滤后需要进行操作步骤是______
(6)写出工业由氧化铝冶炼铝的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
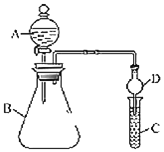
(1)仪器A的名称为______,干燥管D的作用为______。
(2)若要证明非金属性:![]() ,C中为淀粉
,C中为淀粉![]() 碘化钾混合溶液,B中装有
碘化钾混合溶液,B中装有![]() 固体,则A中试剂为______,观察到C中溶液______
固体,则A中试剂为______,观察到C中溶液______![]() 填现象
填现象![]() ,即可证明。从环境保护的观点考虑,此装置缺点______。
,即可证明。从环境保护的观点考虑,此装置缺点______。
(3)若要证明非金属性:![]() ,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼![]() 为
为![]() 价
价![]() 与
与![]() 是常用的火箭推进剂,发生的化学反应如下:
是常用的火箭推进剂,发生的化学反应如下:![]()
![]() ,下列说法不正确的是
,下列说法不正确的是 ![]()
![]()
A.该反应在任何情况下都能自发进行
B.![]() 含有
含有![]() 共价键
共价键
C.反应中,氧化产物为![]() ,还原产物为
,还原产物为![]()
D.反应中,生成![]() 时,转移
时,转移![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 环境科学
环境科学![]() 刊发了我国科研部门采用零价铁活化过硫酸钠
刊发了我国科研部门采用零价铁活化过硫酸钠![]() ,其中S为
,其中S为![]() 价
价![]() 去除废水中的正五价砷
去除废水中的正五价砷![]() 的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为
的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为![]() ,
,![]() 。下列叙述正确的是
。下列叙述正确的是![]()
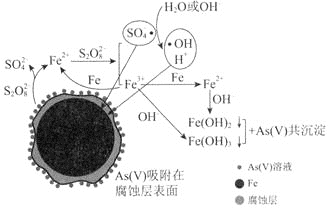
A.![]() 过硫酸钠
过硫酸钠![]() 含
含![]() 个过氧键
个过氧键
B.若![]() 参加反应,共有
参加反应,共有![]() 个
个![]() 被还原
被还原
C.室温下,中间产物![]() 溶于水所得饱和溶液中
溶于水所得饱和溶液中![]() 为
为![]()
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,N表示粒子数。下列叙述正确的是( )
A. 在标准状况下2.24LCCl4中含有的C—Cl键数为0.4NA
B. 将1mol Cl2通入水中,则N(HClO)+N(Cl)+N(ClO)=2NA
C. 将CO2通过Na2O2使其质量增加a g时,反应转移的电子数为aNA/14
D. 3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入50mL 10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质。下列说法正确的是
A.与NaOH反应的氯气物质的量:0.25mol<n(Cl2)<0.5mol
B.若反应中转移的电子为n mol,则0.25<n<0.5
C.溶液中n(Na+):n(Cl-)可能为7:5
D.溶液中n(NaCl):n(NaClO):n(NaClO3)可能为10:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图![]() 甲不一定在丁、庚的连线上
甲不一定在丁、庚的连线上![]() ,戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是
,戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是

A.甲与己形成的化合物一定是离子化合物
B.简单气态氢化物的稳定性:庚![]() 己
己![]() 戊
戊
C.乙、丙、丁的最高价氧化物水化物可以相互反应
D.庚的最高价氧化物水化物酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com