
”¾ĢāÄæ”æ»ÆŗĻĪļAX3ŗĶµ„ÖŹX2ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æÉÉś³É»ÆŗĻĪļAX5”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦AX3(g)£«X2(g)![]() AX5(g)ŌŚČŻ»żĪŖ10 LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ĘšŹ¼Ź±AX3ŗĶX2¾łĪŖ0.2 mol”£·“Ó¦ŌŚ²»Ķ¬Ģõ¼žĻĀ½ųŠŠ£¬·“Ó¦ĢåĻµ×ÜŃ¹ĒæĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
AX5(g)ŌŚČŻ»żĪŖ10 LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ĘšŹ¼Ź±AX3ŗĶX2¾łĪŖ0.2 mol”£·“Ó¦ŌŚ²»Ķ¬Ģõ¼žĻĀ½ųŠŠ£¬·“Ó¦ĢåĻµ×ÜŃ¹ĒæĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
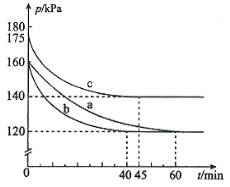
¢Ł Ķ¼ÖŠ3×鏵Ńé“Ó·“Ó¦æŖŹ¼ÖĮ“ļµ½Ę½ŗāŹ±µÄ·“Ó¦ĖŁĀŹv(AX5)Óɓ󵽊”µÄ“ĪŠņĪŖ (ĢīŹµŃéŠņŗÅ)£»ÓėŹµŃéaĻą±Č£¬ĘäĖūĮ½×éøıäµÄŹµŃéĢõ¼ž¼°ÅŠ¶ĻŅĄ¾ŻŹĒ£ŗb ”¢c ”£
¢ŚÓĆp0±ķŹ¾æŖŹ¼Ź±×ÜŃ¹Ē棬p±ķŹ¾Ę½ŗāŹ±×ÜŃ¹Ē棬¦Į±ķŹ¾AX3µÄĘ½ŗā×Ŗ»ÆĀŹ£¬Ōņ¦ĮµÄ±ķ“ļŹ½ĪŖ £»ŹµŃéaĘ½ŗā×Ŗ»ÆĀŹ£ŗ¦Į(a)ĪŖ ”£
£Ø2£©ŅŃÖŖAX3µÄČŪµćŗĶ·Šµć·Ö±šĪŖ£93.6 ”ęŗĶ76 ”ę£¬AX5µÄČŪµćĪŖ167 ”ę”£ŹŅĪĀŹ±AX3ÓėĘųĢåX2·“Ӧɜ³Élmol AX5£¬·Å³öČČĮæ123.8 kJ”£øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
”¾“š°ø”æ
£Ø1£©¢Łbca(2·Ö)b:¼ÓČė“߻ƼĮ£®·“Ó¦ĖŁĀŹ¼Óæģ£¬µ«Ę½ŗāµćƻӊøıäC:ĪĀ¶ČÉżøß”£·“Ó¦ĖŁĀŹ¼Óæģ£¬µ«Ę½ŗāµćĻņÄę·“Ó¦·½ĻņŅʶÆ(»ņ·“ӦȯĘ÷µÄČŻ»żŗĶĘšŹ¼ĪļÖŹµÄĮæĪ“øı䣬µ«ĘšŹ¼×ÜŃ¹ĒæŌö“ó)
¢Ś¦Į=2(1-p/p0)£»50%
£Ø2£©AX3(l)+X2(g)=AX5(s)”÷H=”Ŗ123.8kJmol”Ŗ1
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©¢Łøł¾Żµ½abc“ļĘ½ŗāÓĆŹ±µÄ¶ąÉŁæÉŅŌ±Č½Ļ³ö·“Ó¦ĖŁĀŹµÄ“óŠ”ĪŖ£ŗb£¾c£¾a£»ÓėŹµŃéaĻą±Č£¬bŹµŃéµ½“ļĘ½ŗāµÄŹ±¼ä±äŠ”£¬µ«Ę½ŗāƻӊ·¢ÉśŅĘ¶Æ£¬ĖłŅŌĪŖŹ¹ÓĆ“ß»Æ¼Į£»cŹµŃéµ½“ļĘ½ŗāŹ±×ÜŃ¹Ēæ±ä“ó£¬ĖµĆ÷Ę½ŗāÄęĻņŅĘ¶Æ£¬¶ų»Æѧ·“Ó¦ĖŁĀŹ±ä“ó£¬æ¼ĀĒµ½øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĖłŅŌŹĒÉżøßĪĀ¶ČĖłµ¼ÖĀµÄ£»
¢ŚÓĆp0±ķŹ¾æŖŹ¼Ź±×ÜŃ¹Ē棬p±ķŹ¾Ę½ŗāŹ±×ÜŃ¹Ē棬¦Į±ķŹ¾AX3µÄĘ½ŗā×Ŗ»ÆĀŹ£¬øł¾ŻŃ¹ĒæÖ®±Č¾ĶµČÓŚĪļÖŹµÄĮæÖ®±ČÓŠ£ŗ![]() £¬n=
£¬n=![]() £¬
£¬
AX3(g)+X2(g)![]() AX5(g)
AX5(g)
³õŹ¼ (mol) 0.20 0.20 0
Ę½ŗā (mol) 0.20-x 0.20-x x
(0.20-x)+(0.20-x)+x=n
x=0.40-n=0.4-![]() £¬
£¬
¦Į=![]() ”Į100%=2(1-P/P0)”Į100%,”ą¦Įa=2(1-P/P0)=2(1-120/160)=50%£»
”Į100%=2(1-P/P0)”Į100%,”ą¦Įa=2(1-P/P0)=2(1-120/160)=50%£»
£Ø2£©ŅņĪŖAX3µÄČŪµćŗĶ·Šµć·Ö±šĪŖ-93.6”ęŗĶ76”ę£¬AX5µÄČŪµćĪŖ167”ę£¬ŹŅĪĀŹ±£¬AX3ĪŖŅŗĢ¬£¬AX5ĪŖ¹ĢĢ¬£¬Éś³É1mol AX5£¬·Å³öČČĮæ123.8kJ£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢĪŖ£ŗAX3(l)+X2(g)=AX5(s)”÷H=-123.8kJmol-1”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉNOŗĶCO×é³ÉµÄ»ģŗĻĘųĢåÓėĶ¬ĪĀĶ¬Ń¹ĻĀæÕĘųµÄĆܶČĻąµČ£ØæÕĘųµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ29£©£¬ĻĀĮŠ¹ŲĻµÕżČ·µÄŹĒ£Ø £©
A. »ģŗĻĘųĢåÖŠ£¬COÓėNOÖŹĮæ±Č15:14
B. »ģŗĻĘųĢåÖŠ£¬COÓėNO·Ö×ÓøöŹż±Č1:2
C. »ģŗĻĘųĢåÖŠCOÕ¼ÓŠµÄĢå»ż“óÓŚNOÕ¼ÓŠµÄĢå»ż
D. »ģŗĻĘųĢåÖŠ£¬COÓėNOĆܶȱČ14:15
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ĻĀĮŠÓŠ¹Ųµē½āÖŹČÜŅŗµÄĖµ·ØÕżČ·µÄŹĒ
A. pH=2µÄH2SO4ÓėpH=12µÄNaOHµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗ³ŹĖįŠŌ
B. 0.1mol/LµÄCH3COOHČÜŅŗŌŁ¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠ![]() ¼õŠ”
¼õŠ”
C. pH=5µÄNaHSO3ČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČŠ”ÓŚ“æĖ®µÄµēĄė³Ģ¶Č
D. 0.1mol/LµÄNaHCO3ČÜŅŗÖŠ£ŗc(OH-)=c(H+)+2c(H2CO3)+c(HCO3-£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬0.1molL-1ijŅ»ŌŖĖį(HA)ČÜŅŗ![]() ÖŠ= 1”Į10-8£¬ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄijŅ»ŌŖ¼ī(BOH)ČÜŅŗÖŠ
ÖŠ= 1”Į10-8£¬ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄijŅ»ŌŖ¼ī(BOH)ČÜŅŗÖŠ![]() = 1”Į1012£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
= 1”Į1012£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
A£®PH=aµÄHAČÜŅŗ£¬Ļ”ŹĶ10±¶£¬ĘäpH=a+1
B£®µČĢå»żµÄHAŗĶBOHĒ”ŗĆĶźČ«·“Ó¦£¬ČÜŅŗµÄpH=7
C£®HAµÄpH=3£»BOHµÄpH=13
D£®ĻąĶ¬Ģå»żĻąĶ¬pHµÄHAŗĶŃĪĖį·Ö±šÓė×ćĮæZn·“Ó¦£¬Éś³ÉĒāĘųµÄĪļÖŹµÄĮæĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ»śĪļµÄĆüĆūÖŠ£¬ÕżČ·µÄŹĒ
A. 2£¬4-¶ž¼×»ł¶”Ķé B. 2£¬3£¬3-Čż¼×»ł¶”Ķé
C. 2-ŅŅ»łĪģĶé D. 2£¬3-¶ž¼×»łĪģĶé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”ææÉÄę·“Ó¦2SO2+O2![]() 2SO3£¬ČōÓĆ2 mol SO2ŗĶ1 mol 18O2ŌŚŅ»¶ØĢõ¼žĻĀ£¬¾×ć¹»³¤µÄŹ±¼ä·“Ó¦£¬ĻĀĮŠĒéæöæÉÄܳöĻֵďĒ
2SO3£¬ČōÓĆ2 mol SO2ŗĶ1 mol 18O2ŌŚŅ»¶ØĢõ¼žĻĀ£¬¾×ć¹»³¤µÄŹ±¼ä·“Ó¦£¬ĻĀĮŠĒéæöæÉÄܳöĻֵďĒ
A. Éś³É2 mol ČżŃõ»ÆĮņ B. 18OĶźČ«“ęŌŚÓŚČżŃõ»ÆĮņÖŠ
C. 18O½ö“ęŌŚÓŚŃõĘų”¢ČżŃõ»ÆĮņÖŠ D. 18O“ęŌŚÓŚŃõĘų”¢¶žŃõ»ÆĮņ”¢ČżŃõ»ÆĮņÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖÄÖÖĪļÖŹµÄČÜŅŗ£¬ĘäÖŠŅ»ÖÖÓėĘäĖüČżÖÖÄÜ·¢ÉśĄė×Ó·“Ó¦£¬ÕāÖÖĪļÖŹŹĒ£Ø £©
A.Ba£ØOH£©2
B.Na2CO3
C.H2SO4
D.NaOH
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖįŹ½ŃĪNaHBŌŚĖ®ČÜŅŗÖŠ£¬HB-µÄµēĄė³Ģ¶ČŠ”ÓŚHB-µÄĖ®½ā³Ģ¶Č£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®HB-Ė®½ā·½³ĢŹ½£ŗHB-+H2O![]() H3O++ B2-
H3O++ B2-
B£®ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”ĪŖ£ŗc(Na+) > c(HB-)> c(B2-) > c(OH-) > c(H+)
C£®NaHBµÄ“ęŌŚ“Ł½ųĮĖĖ®µÄµēĄė
D£®ĻąĶ¬ĪļÖŹµÄĮæÅضČČÜŅŗµÄpHÖµ£ŗNaHB > Na2B
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚCO2ÖŠ£¬MgČ¼ÉÕÉś³ÉMgOŗĶC”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ŌŖĖŲCµÄµ„ÖŹÖ»“ęŌŚ½šøÕŹÆŗĶŹÆÄ«Į½ÖÖĶ¬ĖŲŅģŠĪĢå
B. Mg”¢MgOÖŠĆ¾ŌŖĖŲĪ¢Į£µÄ°ė¾¶£ŗr(Mg2+)>r(Mg)
C. ŌŚøĆ·“Ó¦Ģõ¼žĻĀ£¬MgµÄ»¹ŌŠŌĒæÓŚCµÄ»¹ŌŠŌ
D. øĆ·“Ó¦ŹōÓŚ·ĒŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com