
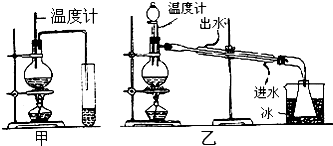
分析 (1)制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近;
(2)液体加热要加碎瓷片,防止暴沸;
(3)反应中需要控制反应温度在170℃,温度计需要测量混合液的温度;
(4)根据乙醇的沸点(78℃)与反应温度(140℃)相差不大,随反应温度的提高会有较多的乙醇挥发出来,故应考虑用Na2CO3溶液将乙醚与乙醇分离;
(5)温度过高发生消去反应成烯,产物为乙烯.
解答 解:(1)通过乙醚的沸点(34.6℃)以及易燃烧可以确定制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,
故答案为:乙; 冷却效果好,乙醚远离火源;
(2)因乙醇的沸点低,易暴沸,所以加入沸瓷片作沸石,防暴沸,
故答案为:防止暴沸;
(3)温度计测量的是混合液的温度,所以温度计水银球应该插入反应物液面以下,但不能触及瓶底,
故答案为:插入反应物液面以下,但不能触及瓶底;
(4)由于乙醇的沸点(78℃)与反应温度(140℃)相差不是太大,随着反应温度的提高会有较多的乙醇挥发出来,所以应考虑用Na2CO3溶液将乙醚与乙醇分离,
故答案为:乙醇; 将其与饱和Na2CO3溶液混合,静置分液;
(5)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,该反应属于消去反应,故答案为:消去反应;乙烯.
点评 本题通过实验室制乙醚方法,主要考查了考查了获取信息的能力与对已学知识的迁移能力,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸只表现脱水性 |
| B | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 氯的非金属性比碳强 |
| C | 向某溶液中加入浓NaOH溶液并加热, 在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | SO2通入品红溶液中 | 溶液褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | KAl(SO4)2 | C. | KHCO3 | D. | K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
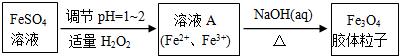
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
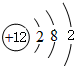 、
、 ,C的离子结构示意图
,C的离子结构示意图
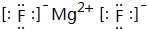 化学键类型为离子键.
化学键类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
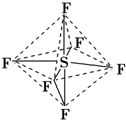
| A. | 六氟化硫中各原子均为8电子稳定结构 | |
| B. | 六氟化硫易燃烧生成二氧化硫 | |
| C. | 六氟化硫分子中含极性键、非极性键 | |
| D. | S-F键是σ键,且键长、键能都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
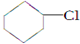 (一氯环己烷)$→_{△②}^{NaOH、乙醇}$
(一氯环己烷)$→_{△②}^{NaOH、乙醇}$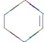 $→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B $\stackrel{④}{→}$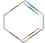
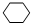 ,名称是环己烷.
,名称是环己烷.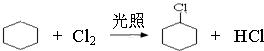 、
、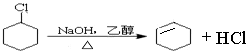 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com