
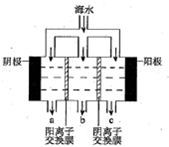
 海水中主要离子的含量如下:
海水中主要离子的含量如下:| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
分析 (1)碳酸氢根发生水解呈碱性;
(2)氢离子在阴极上产生氢气,此时阴极中集聚了大量氢氧根离子,并与镁离子生成Mg(OH)2白色沉淀,同时又和碳酸氢根生成碳酸根离子,碳酸根又和钙离子结合生成CaCO3;
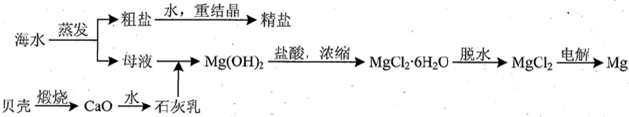
(3)①氯化钠的溶解度随温度变化不大,故蒸发的目的不是得到热饱和溶液,而是把水蒸出使晶体析出,最后应蒸发至有较多晶体析出时为止;
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液;
(4)①饱和Mg(OH)2溶液呈碱性;
②取一定体积的海水,加入足量盐酸除掉碳酸氢根,再加入足量NaOH,将Mg2+转为Mg(OH)2.由25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.求得1L溶液中镁离子的质量为5×10-4mol/L×24g/mol=1200mg/L.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为$\frac{1200-1272}{1272}×100%$=-5.6%.
解答 解:(1)常温下,海水的pH在7.5~8.6之间,其原因是存在碳酸氢根发生水解呈碱性,离子方程式为HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
(2)氢离子在阴极上产生氢气,此时阴极中集聚了大量氢氧根离子,并与镁离子生成Mg(OH)2白色沉淀,同时又和碳酸氢根生成碳酸根离子,碳酸根又和钙离子结合生成CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2;Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)①氯化钠的溶解度随温度变化不大,故蒸发的目的不是得到热饱和溶液,而是把水蒸出使晶体析出,最后应蒸发至有较多晶体析出时为止,选择bd,
故答案为:bd;
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是溶液表面形成晶膜,
故答案为:溶液表面形成晶膜;
(4)①饱和Mg(OH)2溶液中滴加酚酞,由于溶液呈碱性,现象是溶液变红,故答案为:溶液变红;
②取一定体积的海水,加入足量盐酸除掉碳酸氢根,再加入足量NaOH,将Mg2+转为Mg(OH)2.由25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.求得1L溶液中镁离子的质量为5×10-4mol/L×24g/mol=1200mg/L.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为$\frac{1200-1272}{1272}×100%$=-5.6%
故答案为:盐酸;-5.6.
点评 本题考查了海水淡化的电渗析原理的分析判断,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,海水中溴的提取过程,溶液中得到固体的条件应用,反应过程中的氧化剂计算,注意氯气两次氧化消耗,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:
Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:| 序号 | 48mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
| ① | 水 | 2 g NaHCO3 | 20.0 | 18.6 |
| ② | 水 | 2 g Na2CO3 | 20.0 | 21.6 |
| ③ | 盐酸(0.1mol•L-1) | 2 g NaHCO3 | 20.0 | 17.2 |
| ④ | 盐酸(0.1mol•L-1) | 2 g Na2CO3 | 20.0 | 22.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>Cu2+>MnO2 | B. | MnO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>MnO2>Cl2 | D. | Cu2+>Fe3+>Cl2>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
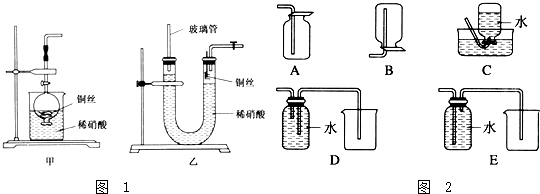
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
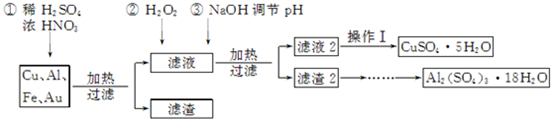
| 温度(K) | 失重(%) | |
| 第一阶段 | 323~523 | 40.54 |
| 第二阶段 | 553~687 | 48.65 |
| 第三阶段 | 1 043以上 | 84.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
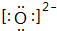 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com