
| 12x |
| 12x+8 |
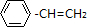 ; 若其不能与氢气发生加成反应,且每个碳原子与另外三个碳原子相连接,键角为90度,判断结构为立方烷,则其结构式为:
; 若其不能与氢气发生加成反应,且每个碳原子与另外三个碳原子相连接,键角为90度,判断结构为立方烷,则其结构式为: 结构中8个氢原子完全等同它的一氯代物有1种; 二氯代物有3种;
结构中8个氢原子完全等同它的一氯代物有1种; 二氯代物有3种;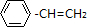 ;
; ;1;3.
;1;3.


科目:高中化学 来源: 题型:
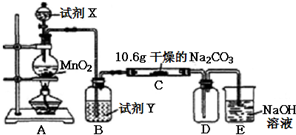
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. |  |
| 步骤2:向A试管中滴加 | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加 | 若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
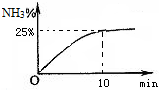 含氮化合物对人类生活有十分重大的意义.
含氮化合物对人类生活有十分重大的意义.| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(aq) |
| △ |
| CO2 |
| O2/点燃 |
| H2O |
| 蒸干 |
| △ |
| HCl(aq) |
| △ |
| 石灰乳 |
| 煅烧 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 摩尔质量(g/mol) | 278 | 140.6 | 413.6 |
| 密度(g/cm3) | 2.70 | 3.22 | 3.50 |
| A、钙长石生成 |
| B、镁橄榄石生成 |
| C、钙长石和镁橄榄石共存 |
| D、(钙镁)石榴子石生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL、212 g |
| B、950mL、201.4 g |
| C、500mL、286 g |
| D、任意规格、572 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com