
| A. | ①② | B. | ①③ | C. | ③② | D. | ②④ |
科目:高中化学 来源: 题型:选择题
| A. | a:Fe b:FeCl3 c:FeCl2 | B. | a:AlCl3 b:Al(OH)3 c:Al2O3 | ||
| C. | a:N2 b:NH3 c:NO2 | D. | a:SO2 b:SO3 c:H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
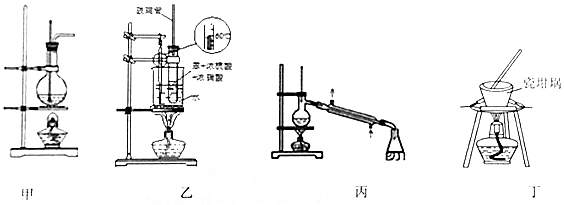
| A. | 装置甲:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 | |
| B. | 装置乙:实验室中可用此装置来制备硝基苯 | |
| C. | 装置丙:实验室中可用此装置来分离含碘的四氯化碳溶液,最终在锥形瓶中收集到碘 | |
| D. | 用装置丁加热熔融NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

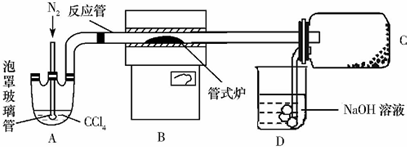
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | 滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布盖灭 | |
| B. | 在取用NaOH固体时,发现取量过多,为了不浪费,又把多余的药品放回试剂瓶 | |
| C. | 用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 | |
| D. | 制取并收集氧气结束后,应立即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com