
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH | |
| D. | 镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 |
分析 A.得电子的发生还原反应,失电子的发生氧化反应;
B.用惰性电极电解Na2SO4溶液,阴极上析出氢气,阳极上析出氧气,根据转移电子数相等确定产物的物质的量之比;
C.根据氢氧化钠和转移电子之间的关系式计算;
D.作原电池负极的金属比作原电池正极的金属易腐蚀.
解答 解:A.电解池阴极上得电子发生还原反应,故A错误;
B.用惰性电极电解Na2SO4溶液,阴极上析出氢气,阳极上析出氧气,氢离子得2mol电子生成1mol氢气,4mol氢氧根离子失去4mol电子生成1mol氧气,所以阴阳两极产物的物质的量之比为2:1,故B错误;
C.设生成x氢氧化钠,
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ 转移电子
2mol 2mol
x 0.1mol
x=$\frac{2×0.1}{2}$mol=0.1mol,所以生成0.1mol氢氧化钠,故C正确;
D.镀层破损后,镀锡铁板中铁作负极,镀锌铁板中铁作正极,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
点评 本题考查了原电池和电解池原理,难度不大,注意选项B中生成1mol氧气需要转移4mol电子.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
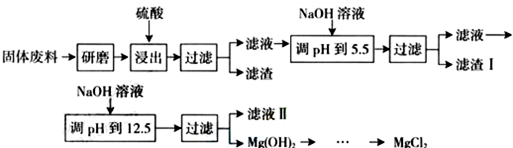
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尽可能使用稀溶液 | B. | 选择合适的催化剂 | ||
| C. | 碾细固体反应物 | D. | 提高反应体系的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2$\stackrel{CO_{2}}{→}$CaCO3$\stackrel{高温}{→}$CaO | B. | Fe$\stackrel{少量Cl_{2}}{→}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 | ||
| C. | Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | D. | SiO2$\stackrel{水}{→}$H2SiO3$\stackrel{NaOH溶液}{→}$Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
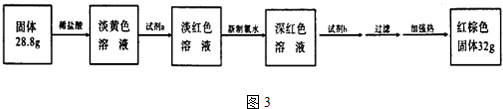
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com