
分析 (1)据钠的保存需要考虑钠的性质,如钠与空气和水发生反应,与四氯化碳、汽油、煤油不反应,钠的密度比四氯化碳小、比煤油、汽油的密度大以及汽油的沸点低于煤油,易挥发;碳酸氢钠受热分解生成碳酸钠;
(2)铁和水蒸气在高温下反应生成四氧化三铁和氢气;
(3)根据NaCl不能和盐酸反应而和NaHCO3能与盐酸反应;
解答 解:(1)据钠的保存需要考虑钠的性质,如钠与空气和水发生反应,与四氯化碳、汽油、煤油不反应,钠的密度比四氯化碳小、比煤油、汽油的密度大以及汽油的沸点低于煤油,易挥发;碳酸氢钠受热分解生成碳酸钠,故答案为:煤油;加热;
(2)高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)因NaCl不能和盐酸反应,NaHCO3能与盐酸反应反应生成氯化钠、水、二氧化碳,生成的氯化钠又溶于水,所以可用盐酸除去混入NaCl溶液中少量NaHCO3杂质,故答案为:盐酸;HCO3-+H+=CO2↑+H2O;
点评 关于物质的分离和提纯,除了要掌握除杂和分离的原则,还要分析杂质和物质性质的不同,然后选择适当的试剂和方法.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯无同分异构体 | B. | 间二甲苯没有同分异构体 | ||
| C. | 邻二甲苯没有同分异构体 | D. | 1 mol苯只能与3 molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
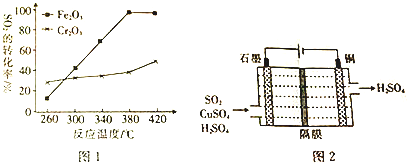
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有NaCl溶液、水等 | |
| B. | 雾是气溶胶,在一段时间内能稳定存在 | |
| C. | 淀粉胶体中含有少景的NaCl,可用适量AgNO3溶液除去 | |
| D. | 医疗上的血液透析与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑ | ||
| C. | Na2CO3+CO2+H2O═2NaHCO3 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
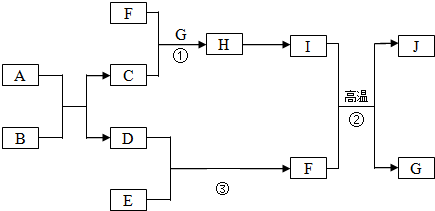
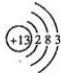 ,B的名称是盐酸或硫酸.
,B的名称是盐酸或硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com