
已知反应FeO(s)+CO(g) = Fe(s)+CO2(g) 的平衡常数K=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加的FeO量会不会促使平衡向正方向移动?
解:(1) 浓度商Q=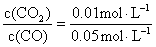 =0.2
=0.2
Q<K,反应将向右进行,
(2) 设平衡时CO2增加的浓度为x mol·L-1,则平衡时:
FeO(s) + CO(g) =Fe(s) +CO2(g)
(mol·L-1) 0.05-x 0.01+x
K=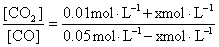 =0.5
=0.5
解之,x=0.01 mol·L-1
[CO]= 0.05 mol·L-1-0.01 mol·L-1=0.04 mol·L-1
[CO2]=0.01 mol·L-1+0.01 mol·L-1=0.02 mol·L-1
(3)增加的FeO量不会促使平衡向正方向移动。
答:CO和CO2的平衡浓度分别为0.04 mol·L-1 、0.02 mol·L-1;CO的转化率为20% 。增加的FeO量不会促使平衡向正方向移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的Kc=0.5(1 273 K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
Fe(s)+CO2(g)的Kc=0.5(1 273 K)。若起始浓度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(带解析) 题型:计算题
已知反应FeO(s)+CO(g)  Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
查看答案和解析>>
科目:高中化学 来源:2014届浙江省杭州市高二5月月考化学试卷(解析版) 题型:计算题
已知反应FeO(s)+CO(g) 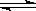 Fe(s)+CO2(g)
的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
Fe(s)+CO2(g)
的Kc=0.5(1273K)。若起始浓度c(CO) = 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应FeO(s)+CO(g) = Fe(s)+CO2(g) 的平衡常数K=0.5(1273K)。若起始浓度c(CO)= 0.05 mol·L-1,c(CO2) = 0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加的FeO量会不会促使平衡向正方向移动?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com