
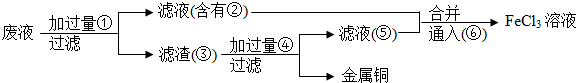
分析 腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故①为Fe,经过滤所得滤液②是氯化亚铁,滤渣③是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量④为盐酸可以将铜分离,得到的滤液⑤为氯化亚铁,滤液合并后通入⑥为氯气,能将亚铁离子氧化为三价铁,以此解答该题.
解答 解:腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故①为Fe,经过滤所得滤液②是氯化亚铁,滤渣③是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量④为盐酸可以将铜分离,得到的滤液⑤为氯化亚铁,滤液合并后通入⑥为氯气,能将亚铁离子氧化为三价铁,
由上述分析可知,①为Fe,②为FeCl2,③为Cu和Fe,④为HCl,⑥为Cl2,
故答案为:Fe;FeCl2;Cu和Fe;HCl;Cl2.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
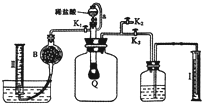 g]
g]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
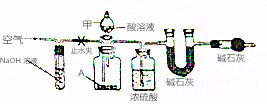 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com