
| 族 周期 | I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
分析 由元素在周期表中位置,可知①为H、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,对应氢化物越稳定;
(3)氢氧化铝属于两性氢氧化物;
(4)利用元素单质相互置换反应可以证明金属性强弱.
解答 解:由元素在周期表中位置,可知①为H、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,原子半径最大为⑤,处于周期表中第三周期IA族,故答案为:三、IA;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,三元素中S的非金属性最弱,故H2S稳定性最差,故答案为:H2S;
(3)Al(OH)3属于两性氢氧化物,用电离方程式表示原因为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:Al(OH)3;H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(4)金属性Al>Fe,利用元素单质相互置换反应可以证明金属性强弱,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:Al;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查元素周期表与元素周期律,需要学生熟练注意元素周期表结构,掌握金属性、非金属性强弱比较实验事实.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:解答题
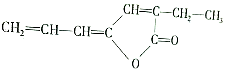 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
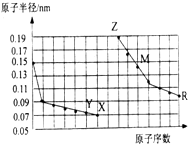
| A. | 简单离子的半径大小比较:Z>Y>X | |
| B. | 气态氢化物稳定性:Y>X>R | |
| C. | 单质的熔点:M>Z | |
| D. | Z单质能从M的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/mn | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | 元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与热的稀硫酸:Cu+2H+═Cu2++H2↑ | |
| B. | 在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++OH-═NH3•H2O | |
| C. | AlCl3溶液滴加过量的氨水:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
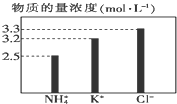
| A. | 2、64、24 | B. | 64、2、24 | C. | 64、24、2 | D. | 16、2、24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com