
恒温恒容下,向2 L密闭容器中加入MgSO4 (s)和CO(g),发生反应:
(s)和CO(g),发生反应:
MgSO4(s)+CO(g) ?MgO(s)+CO2(g)+SO2(g)。反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是( )
A.反应在0~2 min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4 min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,达到平衡时n(CO2)<0.60 mol
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2016-2017学年湖南省高二上10月月考化学卷(解析版) 题型:选择题
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)  C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均摩尔质量
A.②③⑤ B.①②③ C.②③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
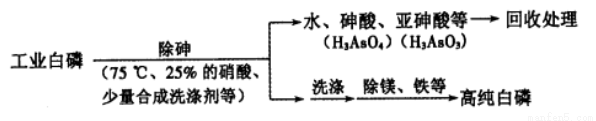
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
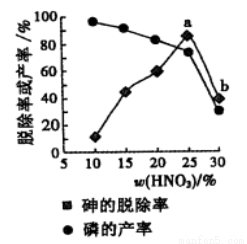
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。
(3)某温度下,已知:
Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s) Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:选择题
下列情况下,反应速率相同的是( )
A.等体积0.1mol/L H2SO4和0.2 mol/L HNO3分别与等质量铜片反应
B.等质量的锌粒和锌粉分别与等体积1 mol/L H2SO4反应
C.等体积0.2 mol/L HCl和0.1 mol/L H2SO4分别与等质量相同形状石灰石反应
D.等体积0.1 mol/L HCl和0.1mol/L HNO3分别与等质量Al2O3粉末反应
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:填空题
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子电子占据的最高能层符号________,基态Ti2+的价电子的电子排布式 。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2?2NH3实现储氢和输氢.下列说法正确的是_________(填序号);
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与C1O4-、PH4+、CH4、BH4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.电负性C<N<O , 第一电离能C< O < N
(3)Se与O同族,则 SeO2分子的空间构型为
(4)富勒 烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
(5)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol﹣1(用含a、ρ的代数式表示).

查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:选择题
液流式铅蓄电池以可溶性的甲基磺酸铅[(CH3SO3)2Pb]代替硫酸作为电解质溶液,该电池充放电的总反应为2Pb2++2H2O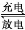 Pb+PbO2+4H+,下列说法正确的是( )
Pb+PbO2+4H+,下列说法正确的是( )
A.该电池放电时,两极质量均增加
B.放电时,正极的电极反应式为PbO2+4H++2e- Pb2++2H2O
Pb2++2H2O
C.充电时,溶液中Pb2+向阳极移动
D.充电时,阳极周围溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,18gH218O所含质子数为10NA
B.1 mol乙醇中含有极性键的 数目为8NA
数目为8NA
C.1mol的﹣NH2与1molNH4+所含电子数均为10NA
D.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考一化学试卷(解析版) 题型:选择题
某溶液中含有大量的的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是:①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液.
A. ①②④②③ B. ④②①②③ C. ①②③②④ D. ④②③②①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学卷(解析版) 题型:实验题
某同学欲配制480 mL 物质的量浓度为0.1mol.L-1的CuSO4溶液。
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、____________,烧杯、玻璃棒、药匙。
(2)如果用CuSO4固体来配制,应该称量固体的质量为_________________。如果用CuSO4.5H2O来配制,应该称量固体的质量为____________________。
(3)写出整个实验简单的操作过程:计算→__________→溶解→转移→洗涤→____________→摇匀。
(4)定容时的正确操作是:待容量瓶中的液体液面距离容量瓶的刻度线1 ~2 cm时,改用___________滴加,并且目光要平视刻度线,至______________,定容完成。
(5)下列操作对溶液的浓度有何影响?用“偏大”“偏小”或“无影响”填空。
① 配制的过程中有少量的液体溅出烧杯。( )
② 使用前容量瓶用蒸馏水洗涤,且没有干燥。( )
③ 定容时俯视液面。( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com