
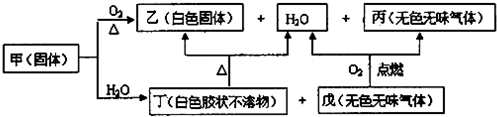
分析 甲、乙、丙、丁、戊是由四种短周期元素中的两种或三种组成的5种化合物,其中乙、丙、戊均由两种元素组成,丙是导致温室效应的主要气体,丙为CO2,戊是天然气的主要成分,戊为CH4,乙和丁都既能与酸反应,又能与强碱溶液反应,应为两性化合物,丁为白色胶状物,所以丁为Al(OH)3,乙为Al2O3,甲由一种金属元素和两种非金属元素组成,其原子个数比为1:3:9,所含原子总数等于其组成中金属元素的原子序数,根据转化关系,甲与水反应生成氢氧化铝和甲烷,所以甲为Al(CH3)3,上述5种化合物涉及的四种元素的原子序数之和等于28,符合转化关系,据此答题.
解答 解:甲、乙、丙、丁、戊是由四种短周期元素中的两种或三种组成的5种化合物,其中乙、丙、戊均由两种元素组成,丙是导致温室效应的主要气体,丙为CO2,戊是天然气的主要成分,戊为CH4,乙和丁都既能与酸反应,又能与强碱溶液反应,应为两性化合物,丁为白色胶状物,所以丁为Al(OH)3,乙为Al2O3,甲由一种金属元素和两种非金属元素组成,其原子个数比为1:3:9,所含原子总数等于其组成中金属元素的原子序数,根据转化关系,甲与水反应生成氢氧化铝和甲烷,所以甲为Al(CH3)3,上述5种化合物涉及的四种元素的原子序数之和等于28,符合转化关系,
(1)根据上面的分析可知,甲为Al(CH3)3,乙为Al2O3,熔点高,可用于高温耐火材料或冶炼金属铝,
故答案为:Al(CH3)3;高温耐火材料或冶炼金属铝;
(2)Al(CH3)3与足量H2O溶液反应生成Al(OH)3和甲烷,反应的化学方程式Al(CH3)3+3H2O═Al(OH)3↓+3CH4↑,
故答案为:Al(CH3)3+3H2O═Al(OH)3↓+3CH4↑;
(3)将过量的NaAlO2通入某种物质的水溶液中可以生成Al(OH)3,应通入二氧化碳,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)乙为Al2O3,乙溶于某强碱溶液生成偏铝根离子,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(5)4.48L CO2通入到200mL 1.5mol/LNaOH溶液中,二氧化碳的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,氢氧化钠的物质的量1.5mol/L×0.2L=0.3mol,
当1<n(NaOH):n(CO2)<2时,生成物是碳酸钠和碳酸氢钠,
根据二氧化碳和氢氧化钠物质的量之间的关系得方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,根据方程式知,碳酸钠和碳酸氢钠的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,则c(OH-)>c(H+),碳酸根离子的水解能力大于碳酸氢根离子,所以c(HCO3-)>c(CO32-),钠离子不水解,离子浓度最大,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(6)Al(OH)3是一种难溶物质,其溶度积常数为1.25×10-33.将0.01mol Al(OH)3投入1L某浓度的盐酸中,则至少需要0.03mol,为使Al(OH)3完全溶解得到澄清透明溶液,反应后c(OH-)=$\root{3}{\frac{1.25×10{\;}^{-33}}{0.01}}$mol/L=0.5×10-10mol/L,则c(H+)=2×10-4mol/L,所以需要盐酸的浓度为3.02×10-2mol/L,
故答案为:3.02×10-2mol/L.
点评 本题考查无机物的推断,为高频考点和常见题型,侧重于学生的分析、计算能力的考查,主要把握常见物质的性质、用途和反应特征,为解答该类题目的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | OH- | C. | S2- | D. | Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阴极发生的电极反应为:2H++2e-=H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由橙色变为黄色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则铬酸钾的转化率为2-d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .合成M的一种途径如下
.合成M的一种途径如下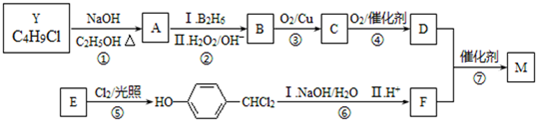
 .
.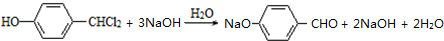 .
. .
.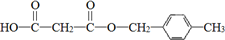 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置制取氯气 | |
| B. | 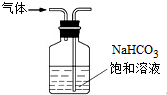 用装置除去氯气中混有的少量氯化氢 | |
| C. | 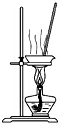 用装置蒸干氯化锰溶液制MnCl2•4H2O | |
| D. |  用装置分离二氧化锰和氯化锰溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量NaOH固体 | |
| B. | 移液前容量瓶内有水珠 | |
| C. | 摇匀后,液面低于刻度线,再加水至刻度线 | |
| D. | 定容时,俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠溶液的PH 大于7 | |
| B. | 常温时,0.1mol/L乙酸溶液的PH约为3 | |
| C. | 乙酸能和碳酸钙反应放出CO2 | |
| D. | PH=1的醋酸溶液用水稀释1000倍后,pH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低反应体系的压强 | B. | 增加反应物碳的用量 | ||
| C. | 缩小反应体系的体积 | D. | 减少体系中CO的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com