
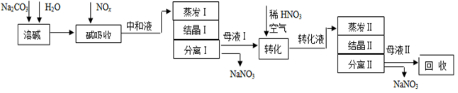
分析 由制备流程可知,碳酸钠溶解后,碱吸收发生Na2CO3+NO+NO2═2NaNO2+CO2、3NO2+H2O=2HNO3+NO、Na2CO3+2HNO3=NaNO3+H2O+CO2↑,然后中和液进行蒸发Ⅰ操作,应避免浓度过大NaNO2析出,蒸发Ⅰ产生的蒸汽中含有少量的NaNO2等有毒物质要回收再循环利用;结晶过滤分离出NaNO3,母液I中主要含NaNO2,母液Ⅰ进行转化时加入稀HNO3、空气,硝酸提供酸性环境,可将NaNO2转化为NaNO3,转化液蒸发、结晶、过滤分离出NaNO3,母液Ⅱ中主要含NaNO3,应在转化液及结晶中提高利用率,以此解答(1)~(3);
(4)生产1.38吨NaNO2时,n(NaNO2)=$\frac{1.38×1{0}^{6}g}{69g/mol}$=2×104mol,NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可知,2n(Na2CO3)=n(NaNO2)+n(NaNO3),结合m=nM计算.
解答 解:由制备流程可知,碳酸钠溶解后,碱吸收发生Na2CO3+NO+NO2═2NaNO2+CO2、3NO2+H2O=2HNO3+NO、Na2CO3+2HNO3=NaNO3+H2O+CO2↑,然后中和液进行蒸发Ⅰ操作,应避免浓度过大NaNO2析出,蒸发Ⅰ产生的蒸汽中含有少量的NaNO2等有毒物质要回收再循环利用;结晶过滤分离出NaNO3,母液I中主要含NaNO2,母液Ⅰ进行转化时加入稀HNO3、空气,硝酸提供酸性环境,可将NaNO2转化为NaNO3,转化液蒸发、结晶、过滤分离出NaNO3,母液Ⅱ中主要含NaNO3,应在转化液及结晶中提高利用率,
(1)由上述分析可知,二氧化氮与碱液反应生成NaNO2,还可生成NaNO3,中和液中含剩余的少量Na2CO3,故答案为:NaNO3;
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是防止NaNO2的析出,蒸发Ⅰ产生的蒸汽中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的溶碱,循环利用,提高利用率,故答案为:防止NaNO2的析出;溶碱;
(3)由上述分析可知,母液Ⅰ进行转化时加入稀HNO3的目的是将NaNO2转化为NaNO3.母液Ⅱ需回收利用,可转入转化液或转入结晶Ⅱ操作,提高其利用率,
故答案为:将NaNO2转化为NaNO3;cd;
(4)生产1.38吨NaNO2时,n(NaNO2)=$\frac{1.38×1{0}^{6}g}{69g/mol}$=2×104mol,NaNO2、NaNO3两种产品的物质的量之比为2:1,则n(NaNO3)=1×104mol,由Na原子守恒可知,2n(Na2CO3)=n(NaNO2)+n(NaNO3),m(Na2CO3)=(2×104mol+1×104mol)×$\frac{1}{2}$×106g/mol=1.59×106g=1.59t,
故答案为:1.59.
点评 本题考查物质的制备流程及混合物分离提纯综合应用,为高考常见题型,把握流程中的反应、分离方法为解答的关键,注意工业生产与环境保护、原料利用率等,侧重分析与应用能力的综合考查,题目难度中等.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| C. | CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | Na2S溶液中:c(Na+)=2(c(S2-)+c(HS-)+c(H2S)) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A-N+m)mol | B. | $\frac{a}{A}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N)mol | D. | $\frac{a}{A}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+ | B. | Ba2+ | C. | K+ | D. | I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
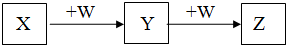 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若W是氢氧化钠,则X与Z可反应生成Y | |
| B. | 若X是硝酸银溶液,则W是氨水 | |
| C. | 若X是H2S,则X、Z的相对分子质量相差可能为30或46 | |
| D. | 若W是单质铁,则Z是FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池属于二次电池 | |
| B. | 回收该电池,可以获取锂元素,有利于节约资源 | |
| C. | 该电池丢入火中可能引起爆炸 | |
| D. | Li+无毒,该电池可随生活垃圾处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PVC(聚氯乙烯)是生活中常用的一种管材,其中聚氯乙烯中含有碳碳双键结构,所以可以使溴水褪色 | |
| B. | 乙炔可以作为氧炔焰的原料气体,是因为其燃烧时火焰的温度很高 | |
| C. | 聚乙烯常用于制造生活常见的塑料制品,其中聚乙烯属于纯净物 | |
| D. | 氯仿(三氯甲烷)是工业上常用的一种溶剂,一般用甲烷和氯气按1:3反应即可生成纯净的氯仿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 或
或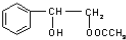 .
.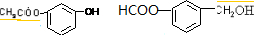 .
.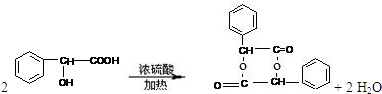 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
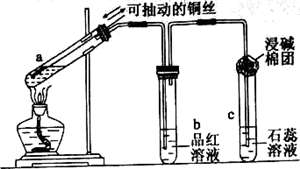
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com