
| ||
| 1min |
| 2b |
| (3-3b)+(1-b)+2b |
| 6 |
| 13 |
| 3b |
| 3 |


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H3O++CO32- |
| B、NH4++OH-?NH3?H2O |
| C、HSO3-+H2O?H2SO3+OH- |
| D、H2O+H2O?H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.表是4种指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.表是4种指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 36.02 | 35.32 | 35.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
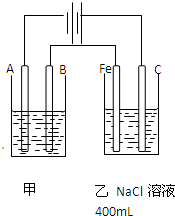 如图所示,甲、乙为互相串联的两个电解池.请回答
如图所示,甲、乙为互相串联的两个电解池.请回答查看答案和解析>>
科目:高中化学 来源: 题型:
| +Cl2 |
| -HCl |
| C6H6 |
| -HCl |

| +浓硫酸 |
| -H2O |
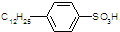
| +NaOH |
| -H2O |

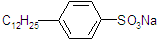 分子中的亲水基是:
分子中的亲水基是:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com