
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
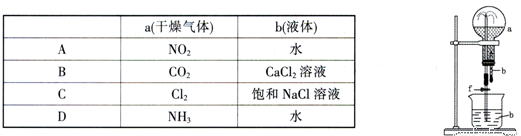
A. A B. B C. C D. D
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷(解析版) 题型:选择题
升高温度能加快化学反应速率的主要原因是( )
A. 增加活化分子百分数 B. 降低活化分子的能量
C. 活化分子能量明显增加 D. 降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源:2017届天津市红桥区高三上学期期末考试(下学期开学考试)化学试卷(解析版) 题型:选择题
常温下,取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
A. C(Na+)-C(X-)=9.9×10-7mol/L
B. C(Na+)=C(X-)+C(HX)=0.2mol/L
C. C(OH-)-C(HX)=C(H+)=1×10-6mol/L
D. 混合溶液中由水电离出的C(OH-)=10-8mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:计算题
黑火药是我国的四大发明之一,深受世人称赞,其反应原理为:
S+3C+2KNO3 N2↑+3CO2↑+K2S
N2↑+3CO2↑+K2S
请回答下列相关问题:
(1)当产生0.1molN2时,反应中共转移电子数为_____,还原剂的物质的量为_____mol。
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是_____mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
某200mLFe2(SO4)3溶液中含有0.1molFe3+,该溶液中SO42-的物质的量浓度为
A. 0.75mol/L B. 0.5mol/L C. 1mol/L D. 0.25mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
下列叙述正确的是
A. 氨水能导电,所以氨水是电解质
B. 氯化氢溶于水后能导电,但液态氯化氢不能导电
C. 溶于水后能电离出H+的化合物都是酸
D. 导电性强的物质一定是强电解质
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:简答题
碘及其化合物在生活中应用广泛。含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列两个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1
反应Ⅱ:HI(aq)=1/2H2(g)+1/2I2(aq) △H2
①反应:SO2(g)+2H2O(1)=H2SO4(aq)+H2(g)的△H=_________(用△H1、△H2表示)。
②反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)  I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。
I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2缓缓通入含1mol I2的水溶液中至恰好完全反应。溶液中I3-的物质的量[n(I3-)]随反应时间(t)的变化曲线如图1所示。开始阶段。N(I3-)逐渐增大的原因是_______________。

(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子,写出氯气与碘单质反应的离子方程式:____________。
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图2是不同PH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附____(填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=________[用c(Cl-)、Kap(AgCl)和Kaq(AgI)表示]。该方法去除碘离子的原理是________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A. 利用浓硫酸的吸水性,干燥氢气
B. 碳酸氢钠溶液呈碱性,可用于治疗胃酸过多
C. 氯化铝是电解质,电解熔融的氯化铝制备金属铝
D. 镁在空气中燃烧时发出耀眼的白光,可用于制造信号弹
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
25 ℃时,Ksp[Mg(OH)2] = 5.61×10-12,Ksp(MgF2)= 7.42×10-11。下列说法正确的是( )
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
C. 25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
D. 25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com