
分析 (1)Fe为26号元素,Cl为17号元素,C为6号元素,据此解答即可;
(2)元素的非金属性越强,其氢化物的还原性越弱,同一周期原子序数越大,半径越小;
(3)阳极失去电子,发生氧化反应,化合价升高,据此解答即可;
(4)利用盖斯定律进行计算即可.
解答 解:(1)Fe为26号元素,除以第四周期第VIII族,价电子排布为:3d44s2,Cl处于第三周期第VIIA族,C原子序数为6,有3个能级,分别是1s、2s和2p,故答案为:3d44s2;第三周期第VIIA族;3;
(2)Cl与S处于同一周期,原子序数越大,非金属性越大,氢化物还原性越弱,故还原性:HCl<H2S,原子序数O>C,故半径C>O,故答案为:<;>;
(3)用电化学法制取Na2FeO4,由图可知Fe为阳极失去电子,则阳极反应为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O;(4)已知①S(s)+O2(g)=SO2(g)△H1=-a kJ•mol-1,②SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H2=-$\frac{9}{2}$$\frac{1}{2}$bkJ•mol-1;
则利用盖斯定律将①+②可得S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H3=(△H1+△H2)=(-a-$\frac{1}{2}$b)kJ•mol-1,故答案为:S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=(-a-$\frac{1}{2}$b)kJ•mol-1.
点评 本题综合考查反应热与焓变,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及盖斯定律的应用.


科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中寻找半导体材料 | |
| B. | 元素周期表中第一列元素都是碱金属元素 | |
| C. | 现行元素周期表是按照元素相对原子质量又小到大的顺序排列 | |
| D. | M层电子为奇数的所有主族元素的族序数与该元素原子的M层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 标准状况下,22.4LCO2与CO的混合气体含NA个分子 | |
| C. | lmolNa2O2与足量CO2反应转移的电子数为2NA | |
| D. | 常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中Cl-离子浓度为0.2mol•L-1 | |
| B. | 1L溶液中Ba2+离子浓度为0.2mol•L-1 | |
| C. | 1L溶液中Cl-离子总数为0.2NA | |
| D. | 1L溶液中Ba2+和Cl-离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
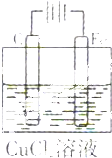
| A. | C棒是阴极 | B. | Cu2+向C棒电极移动 | ||
| C. | Fe电极发生还原反应 | D. | 溶液颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:CaCl2、NaOH、HCl、HD | B. | 同系物:苯、甲苯、乙苯 | ||
| C. | 有机物:橡胶、硅胶、纤维素、乙醇 | D. | 官能团:氯离子、羟基、硝基、苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com