
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| x |
| y |
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
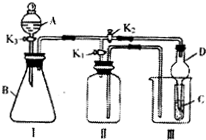 某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.
某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末考试化学试卷(解析版) 题型:实验题
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因________________。
(2)装置C的作用是_________________________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①_________________________________________________________________;
②______ __。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。

该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是___________________________________________________________________________________________________________________________________(要求答出要点)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三第三次模拟考试理综化学试卷(A卷)(解析版) 题型:实验题
某学习小组在实验室模拟侯氏制碱法制备纯碱,其实验流程如下:

请回答下列问题:
(1)食盐溶液中含SO42-等杂质,不能用于除去SO42-的试剂是_________(填序号)。
a. Ba(OH)2 b.Ba(NO3)2 c. BaCl2 d. Na2CO3
(2)实验制备碳酸氢钠用到下列装置:

①实验装置中各接口的连接是d接____,e接_____,c接f。实验过程中先通入氨气的原因_____________。
②析出晶体后的溶液中含有大量的NH4+,检验NH4+的方法是__________________。
③瓶g内的溶液是___________________________________________。
(3)由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(4)用图电解饱和NaC1溶液的方法来制取NaOH、C12和H2。

①反应中生成的C12从_______(填“A”或“B”)放出,检验C12所用试剂(用品)______________________。
②经过长时间电解后,向电解液中滴加酚酞试液,发现溶液并未变红色,试分析可能的原因__________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市十校联合体高二上学期期中考试化学试卷 题型:实验题
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4 ①
HBr+NaHSO4 ①
R-OH+HBr  R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
 密度/g·cm-3 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com