
| A. | 在0.1mol•L-1 Na2SO3溶液溶液中:c(Na+)═2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)═c(CH3COOH)+c(CH3COO-)+2 c(Cl-) |
分析 A.在0.1mol•L-1 Na2SO3溶液溶液中存在物料守恒,n(Na)=2n(S);
B.在0.1 mol•L-1Na2CO3溶液中存在质子守恒,水电离出氢氧根等所有氢离子存在形式;
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液得到等浓度的Na2CO3溶液和NaHCO3溶液,碳酸根路致震水解大于碳酸氢根离子;
D.常温下,CH3COONa和CaCl2混合溶液中氯化钙和醋酸钠的物质的量不知,c(Na+)、c(Ca2+)离子浓度不一定是1:1,溶液中存在电荷守恒.
解答 解:A.在0.1mol•L-1 Na2SO3溶液溶液中存在物料守恒,n(Na)=2n(S),c(Na+)═2c(SO32-)+2c(HSO3-)+2c(H2SO3),故A错误;
B.在0.1 mol•L-1Na2CO3溶液中存在质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),得到c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3),故B正确;
C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液得到等浓度的Na2CO3溶液和NaHCO3溶液,溶液中c(CO32-)<c(HCO3-),故C错误;
D.常温下,CH3COONa和CaCl2混合溶液中:c(Na+)═c(CH3COOH)+c(CH3COO-),c(Ca2+)═2 c(Cl-),c(Na+)、c(Ca2+)离子浓度不一定是1:1,故D错误;
故选B.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、质子守恒、离子浓度大小等,准确理解离子性质、离子电离、离子水解是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
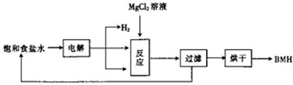 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
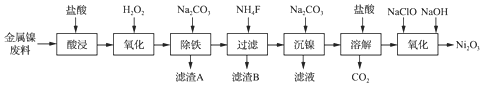
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
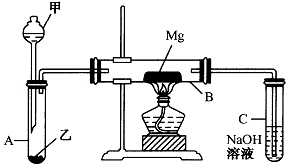 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、K+、I-、Cl- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | K+、Cu2+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gO2和O3的混合气体,含氧原子数为0.4NA | |
| B. | 分子标准状况下,11.2LCCl4中含分子数为0.5NA | |
| C. | 1mol乙酸(忽视挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5 | |
| D. | 常温常压下,7.8gNa2O2含离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ | ⑧ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com