
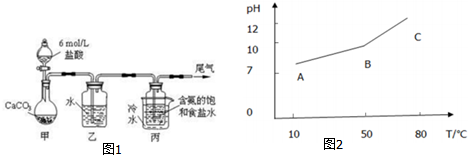
分析 测定碳酸钠纯度时要注意选用不同指示剂计算原理不同,用酚酞作指示剂时,盐酸与碳酸钠反应生成碳酸氢钠即为终点,故样品中含有碳酸氢钠对实验无影响,但选用甲基橙作指示剂,滴定终点呈酸性,则碳酸钠、碳酸氢钠均与盐酸完全反应,故需要考虑样品中碳酸氢钠的影响.
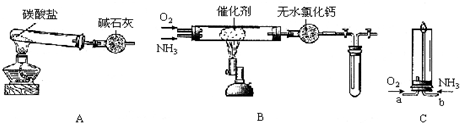
解答 解:(1)根据实验可知,利用盐酸与碳酸钙反应制备二氧化碳,故用水除去二氧化碳中混有的氯化氢气体,除HCl也可以用饱和碳酸氢钠溶液,
故答案为:除去二氧化碳中混有的氯化氢气体;饱和碳酸氢钠溶液;
(2)丙中利用碳酸氢钠溶解度较小,反应生成碳酸氢钠沉淀,发生NH3•H2O+CO2+NaCl=NaHCO3↓+NH4Cl,故答案为:NH3•H2O+CO2+NaCl=NaHCO3↓+NH4Cl;
(3)过滤、洗涤得到碳酸氢钠固体,再灼烧生成碳酸钠,故答案为:过滤、洗涤、灼烧;
(4)用盐酸滴定碳酸钠溶液,可以用酚酞或甲基橙作指示剂,若用酚酞作指示剂,在反应生成NaHCO3即为终点,消耗盐酸为VmL,则碳酸钠为0.0001Vmol,即0.0106V g.故其纯度为0.0106V/m;若用甲基橙作指示剂,则反应生成NaCl,1mol碳酸钠消耗2mol盐酸,样品中含碳酸氢钠也要与盐酸反应,则所含碳酸钠为(0.0084V-m)/62g.故答案为:酚酞(或甲基橙); 0.0106V/m[或(0.0084V-m)/62m];
(5)AB段,酚酞变红,说明碱性增强,因为加热促进碳酸氢钠的水解,BC段,温度较高时,碳酸氢钠分解生成碱性更强的碳酸钠溶液,
故答案为:①HCO3-+H2O≒H2CO3+OH-,△H>0,升温促进水解平衡正向移动,pH上升;
②2NaHCO3?Na2CO3+CO2↑+H2O,温度较高时,使得碳酸氢钠受热分解为碳酸钠,溶液碱性增强;
(6)要验证BC的原因,即验证是否有碳酸钠生成即可,故可以用氯化钡检验碳酸根的存在,故答案为:取回复至室温的溶液少许,向其中滴加氯化钡溶液,产生白色沉淀,说明猜测合理.
点评 本题考查了纯碱的制备及纯碱纯度的测定,碳酸氢钠溶液pH随温度变化的实验探究.注意明确实验装置和实验原理是解题的关键.试题难度中等.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,则转移电子数为2 mol | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
 (或
(或 、
、 ) .
) . $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$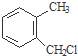 $→_{③}^{NaCN}$
$→_{③}^{NaCN}$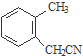 $→_{H_{2}O}^{H_{2}SO_{4}}$
$→_{H_{2}O}^{H_{2}SO_{4}}$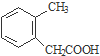
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
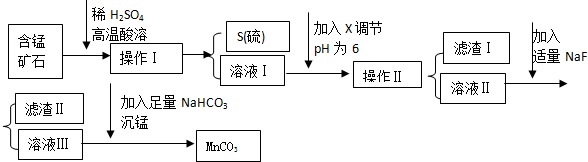
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
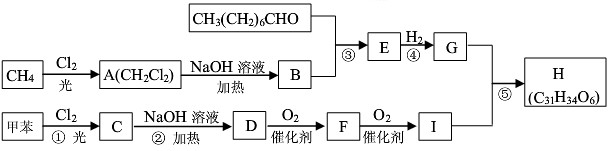
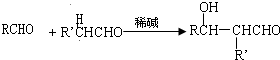
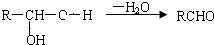
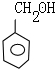 ,E
,E .
. .
.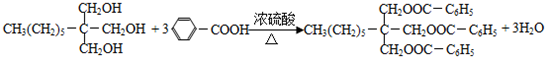 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com