
| A. | 1 mol•L-1 Na2CO3溶液中,含CO32-数目小于NA | |
| B. | 1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02 NA | |
| D. | 1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
分析 A.溶液体积未知;
B.氢氧化铁胶体胶粒是氢氧化铁的集合体;
C.pH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L;
D.1mol苯和1mol苯甲酸燃烧时均消耗7.5mol氧气.
解答 解:A.溶液体积未知,无法计算碳酸根离子个数,故A错误;
B.1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目小于NA,故B错误;
C.pH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L,故1L溶液中氢氧根的物质的量为0.01mol,个数为0.01NA个,故C错误;
D.1mol苯和1mol苯甲酸燃烧时均消耗7.5mol氧气,故1mol苯和苯甲酸的混合物燃烧消耗7.5mol氧气,即7.5NA个氧气分子,与两者的比例无关,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意胶体为离子集合体,题目难度不大.


科目:高中化学 来源: 题型:选择题
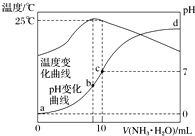 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
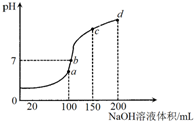 室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )
室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:对图中a、b、c、d四个点分析中,正确的是( )| A. | a点水的电离程度最大 | B. | b点c(NH4+)=2c(SO42-) | ||
| C. | c点c(NH4+)+c(NH3•H2O)=c(Na+) | D. | d点c(NH4+)+c(Na+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
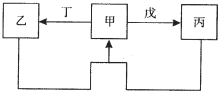 甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )| 选项 | 假设 | 结论 |
| A | 甲为Al(OH)3 | 丁可能是盐酸 |
| B | 甲为Na2CO3溶液 | 戊可能是CO2 |
| C | 甲为Fe | 丁可能是盐酸 |
| D | 甲为N2 | 戊可能是氧气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
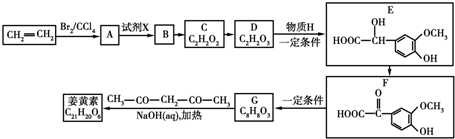


 .
.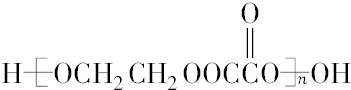 .
.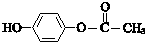 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
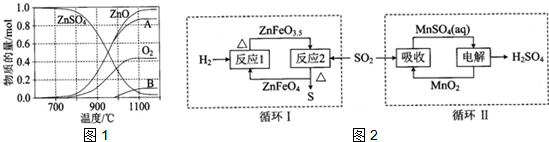
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 反应物 | 反应前 溶液的pH | 温度 |
| 1 | 对照组 | O3+NaI+H2SO4 | 5.2 | 25℃ |
| 2 | ①探究FeCl2对反应速率的影响 | O3+NaI+H2SO4+FeCl2 | 5.2 | 25℃ |
| 3 | 探究温度对反应速率的影响 | O3+NaI+H2SO4 | ②5.2 | 5℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com