
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K= ,SO2的平衡转化率= 。| A.升高温度 | B.降低温度 | C.增大压强 |
| D.减小压强 (E)加入催化剂 (G)移出氧气 |
科目:高中化学 来源:不详 题型:单选题
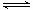 xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
| 到达平衡的时间(min) | 5 | | 8 |
| A的浓度(mol/L) | c1 | c2 | |
| C的体积分数 | w1 | | w3 |
| 混合气体密度(g/L) | ρ1 | ρ2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
 B+D的平衡常数= ,
B+D的平衡常数= ,查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3(g),4min后反应达到平衡状态,测得容器中SO2(g)的转化率为60%,试求,在该温度下:
2SO3(g),4min后反应达到平衡状态,测得容器中SO2(g)的转化率为60%,试求,在该温度下:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
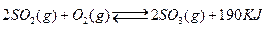
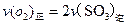 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化 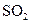 和0.10mol
和0.10mol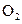 ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含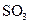 0.18mol,则
0.18mol,则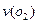 =______
=______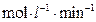 :若继续通入0.20mol
:若继续通入0.20mol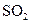 和0.10mol
和0.10mol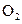 ,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(
,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(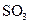 )<______mol。
)<______mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率
入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应
为80%时,该反应 (填“正反应”或“逆反应”) 方向进行。
(填“正反应”或“逆反应”) 方向进行。 cC(g)+dD(g) △H = a kJ·mol
cC(g)+dD(g) △H = a kJ·mol -1;
-1;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学方程式 | K (t1 ) | K (t2) |
  2 2 | 1.8  |  |
   |  |  |
   |  |  |
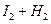  2HI 2HI | 43 | 34 |
 生成HX,用原子结构解释原因: 。
生成HX,用原子结构解释原因: 。 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。 的转化率逐渐降低
的转化率逐渐降低 与
与 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe
Fe
 +S
+S
 ,
, )·c(s
)·c(s )=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
)=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com