
下列物质中,不能与二氧化硅反应的是( )
A.烧碱 B.氢氟酸 C.硝酸 D.生石灰
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:阅读理解

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 2 | 4 | 0.9 | t |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:2016届安徽省濉溪县高一上学期期末考试化学试卷(解析版) 题型:填空题
化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中镁的总储量约为1.8×1015 t,海水里镁的存在形式主要是 。(填“游离态”或“化合态”)
②下列物质不经过化学变化就能从海水中获得的是 。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①工业上制造光导纤维的基本原料是 。
②下列物质中,不能用来制造耐火材料的是 。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
(3)保持洁净安全的生存环境已成为全人类的共识。
①pH< 的雨水称为酸雨。
②下列物质中,会破坏臭氧层的是 。(填字母)
A.氮气 B.一氧化碳 C.氟氯烃
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 H2+I2
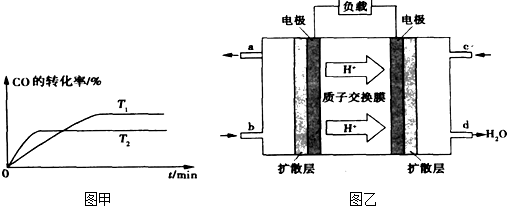
H2+I2  CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: 

查看答案和解析>>
科目:高中化学 来源:同步题 题型:推断题


 ⑥(NH4)2CO3 ⑦NaHCO3 ⑧纤维素 ⑨蛋白质 ⑩NH4I
⑥(NH4)2CO3 ⑦NaHCO3 ⑧纤维素 ⑨蛋白质 ⑩NH4I 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com