
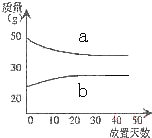
| A. | a挥发、b吸水 | B. | a升华、b冷凝 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钠(固体) | B. | 水 | ||
| C. | 硫酸钾溶液 | D. | 10 mL1mol•L-1 H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生不相关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
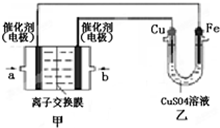
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与石墨都能导电,但都属于非电解质 | |
| B. | AgCl与BaSO4都是难溶性盐,但都属于强电解质 | |
| C. | SO2与CaO都是氧化物,因此SO2、CaO都是非电解质 | |
| D. | NaCl与HCl都是电解质,因此熔融NaCl、液态HCl都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的化合物都是共价化合物 | |
| B. | 酸、碱发生反应,只要生成1mol水放出的热量就相同 | |
| C. | 原电池工作时电流从正极流向负极 | |
| D. | 某物质溶于水得到的溶液可以导电,则该物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 NaOH H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com