
| A、30% | B、40% |
| C、50% | D、60% |
| 24 |
| 40 |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、向澄清石灰水中通少量二氧化碳:Ca(OH)2+CO2=CaCO3↓+H2O |
| B、稀盐酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、锌片插入硝酸银溶液中:Zn+2Ag+=Zn2++2Ag |
| D、硫酸钠溶液与氯化镁溶液的反应:SO42-+Mg2+=MgSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g 苯含有C=C双键的数目为3NA |
| B、常室温下,1LpH=13的Ba(OH)溶液中,溶液中的OH-离子数目为0.2NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生NA个SO2气体分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
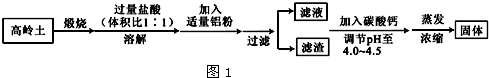
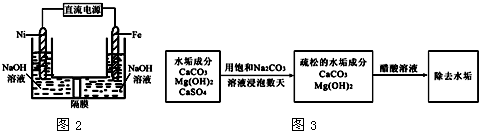
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、真丝、人造丝灼烧时都有烧焦羽毛的气味 |
| B、淀粉、纤维素、油脂都是高分子化合物 |
| C、氨基酸分子中既有氨基,又有羧基,它是两性化合物 |
| D、许多蛋白质在水中有一定的溶解性,溶于水形成胶体.加入浓的硫酸钠溶液,有沉淀析出,这种作用称为变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23g金属钠变为钠离子时失去的电子数为NA |
| B、12 g C-13含有的原子数为NA个 |
| C、标准状况下,22.4L氦气所含的原子数目为2NA |
| D、常温常压下,28g N2和CO的混合气体所含原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com