
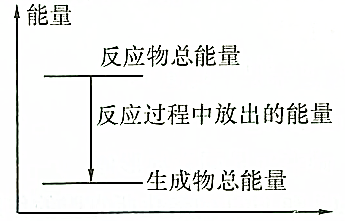
| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
分析 A、根据放热反应中反应物的总能量大于生成物的总能量;
B、放热反应中反应物的总能量大于生成物的总能量;
C、原电池的负极失去电子;
D、根据总反应方程式以及气体的体积与状态有关来计算;.
解答 解:A、放热反应Zn+H2SO4═ZnSO4+H2↑,则反应物的总能量大于生成物的总能量,故A正确;
B、放热反应中反应物的总能量大于生成物的总能量,则无法比较1molZn与1 molH2的能量,故B错误;
C、Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故C错误;
D、Zn+H2SO4 =ZnSO4 +H2↑
65g 22.4L
65g 11.2L
所以32.5g锌溶解时,正极放出气体在标况下11.2L,没有说明温度和压强,气体体积不一定为11.2L,故D错误;
故选A.
点评 本题主要考查原电池原理、化学反应中的能量以及化学计算等,难度不大,根据课本知识即可完成.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:X | D和E 1:3 | B和E 1:4 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com