
��2L�ĺ���������,����1molA��3molB������һ�������·������·�Ӧ��
A��s��+3B��g�� 2C��g��
2C��g��
����3s����C��Ũ��Ϊ0.6mol•L��1������ѡ��˵����ȷ�������
����A��ʾ�ķ�Ӧ����Ϊ0.1mol•L��1•s��1
����B��ʾ�ķ�Ӧ����Ϊ0.4mol•L��1•s��1
��3sʱ����C�����ʵ���Ϊ1.2 mol
��3sʱB��Ũ��Ϊ0.6mol•L��1
A���٢ڢ� B���٢ۢ� C���ۢ� D���ڢۢ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ�ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
�йػ� ����������ᴿ�ķ����㷺����ʵ���о���������
����������ᴿ�ķ����㷺����ʵ���о���������

������ͼװ�ûش��������⣺
(1)����װ��A����CCl4���屽�Ļ����(��֪CCl4���屽���ܣ��е�ֱ�Ϊ76.75���156.2��)����ʵ��ʱ��ȴˮ�������ܵ� (�a����b��)��ͨ�룻�¶ȼƶ���Ϊ80��ʱ����ƿ���ռ����������� ��
(2)װ��B�������ٵ������� ����װ��B��������ʱ��ΪʹҺ��˳�����£�Ӧ���еIJ����� ��
(3)�����к���������ɳ��MgCl2��CaCl2�������Σ��������ܽ������װ��C����ɳ��ȥ����ȥ��ɳ�����һ���ᴿ�������ᴿ�����У��ټ��������Na2CO3��Һ���ڼ��������BaCl2��Һ���ۼ��������NaOH��Һ���ܵ�����ҺPH����7�����ܽ⣻���ˣ�����������ȷ�IJ���˳���� ��
A.�ݢڢۢ٢ޢܢ� B.�ݢ٢ڢۢޢܢ� C.�ڢ٢ۢܢޢ� D.�ݢۢڢ٢ޢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ���������ճ�������������Ҫ��Ӧ�á�����˵������ȷ����( )
A����ҵ�ϵ������Al2O3�Ʊ�������
B���ں������������п�飬�ɼ�������ĸ�ʴ����
C������п��ϡ���ᷴӦ��ȡ��������п�ȴ�п��Ӧ���ʿ�
D�����MgCl2������Һ�����Ƶý���þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ������
������̼�Ļ��������ǻ��������о��ȵ㡣
��1����̫���ܵ������£���CO2Ϊԭ����ȡ̿�ڵ���������ͼ��ʾ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
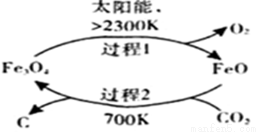
��2����һ����CO2�����״�ȼ�ϵķ�����CO2��3H2 CH3OH��H2O����֪298K��101KPa�����£�
CH3OH��H2O����֪298K��101KPa�����£�
CO2(g)��3H2(g) CH3OH(g)��H2O(l) ��H����a kJ��mol��1��
CH3OH(g)��H2O(l) ��H����a kJ��mol��1��
2H2(g)��O2(g)��2H2O(l) ��H����b kJ��mol��1��
CH3OH(g)��CH3OH(l) ��H����c kJ��mol��1��
��CH3OH(l)�ı�ȼ���ȡ�H��___________________��
��3��CO2�������⻯�ϳɵ�̼ϩ�����ϳ���ϩ��ӦΪ
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) ��H<0
CH2= CH2(g) +4H2O(g) ��H<0
�ں����ܱ������г���2 mol CO2��n mol H2����һ�������·�����Ӧ��CO2��ת�������¶ȡ�Ͷ�ϱ� �Ĺ�ϵ����ͼ��ʾ��
�Ĺ�ϵ����ͼ��ʾ��

��ƽ�ⳣ��KA KB
��T Kʱ��ij�ܱ���������������Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min��ֻ�ı���ijһ�����������ϱ��е������жϸı������������
A��ͨ��һ����H2 B��ͨ��һ����CH2=CH2
C��������ʴ��� D����С�������
����CH2=CH2��Ũ���淴Ӧʱ��ı仯���ߡ�

��4���ڴ���M�������£�CO2��H2ͬʱ��������������Ӧ
A��2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) ��H< 0
CH2= CH2(g) +4H2O(g) ��H< 0
B��2CO2(g) + 6H2(g)  CH3OCH3(g)+3H2O(g) ��H< 0
CH3OCH3(g)+3H2O(g) ��H< 0
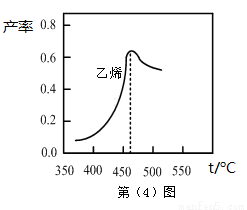
��ͼ����ϩ����ͬʱ���ڣ���ͬ�¶��µIJ��ʣ������460��ʱ��ϩ���ʽ��͵�ԭ������
A������M�Ļ��Խ��� B��A��Ӧ��ƽ�ⳣ�����
C�����ɼ��ѵ������� D��B��Ӧ�Ļ������
��5��Na2CO3��ҺҲͨ����������CO2�������£�H2CO3�ĵ�һ�����ڶ������볣���ֱ�ԼΪKa1=4��10-7 ��Ka2=5��10-11����0.5mol��L��1��Na2CO3��Һ��pH���� �������ǵڶ���ˮ���H2O�ĵ��룩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��10.0mL 0.10mol��L-1��ˮ�е���0.10mol��L?1�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ�������������ݳ����������й�������ȷ����
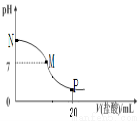
A��M-N��һ������c(Cl��)�� c(NH+ 4)��c(OH��)��c(H+)
B��M���Ӧ���������Ϊ10.0mL
C��pH��7��Һ����c(NH+ 4)= c(Cl��)= c(H+)=c(OH��)
D��P�㴦����Һ�д��ڣ�2c(NH+ 4)+2c(NH3?H2O��=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ����ȷ����
A��NaHCO3��NaOH��Һ��Ӧ��HCO3-��OH-===CO32-��H2O
B��������ˮ��Ӧ��Cl2��H2O  2H+��Cl����ClO��
2H+��Cl����ClO��
C���Ȼ�����Һ�м��������İ�ˮ��Fe3+ �� 3NH3��H2O = Fe(OH)3 ��+ 3NH4+
D��ʢ�ż����Լ�����Һ�����ò�������ԭ��SiO2��2OH��===SiO32-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���㽭ʡ��УЭ���������ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A�������Ƶ�ˮ��Һ�׳��ݻ��������ճ�ϼ��ͷ������
B���ⵥ���ڱ��е��ܽ�Ƚϴ��ñ���ȡ��ˮ�еĵⵥ��
C��С�մ���������Ʒ��ͷۣ�ҽ����Ҳ������������θ�����
D��Ũ�������ǿ�����ԣ����ܸ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ں��º��ݵ��ܱ������У�������Ӧ��3A(g)+B(g)  xC(g)��3mol A��2mol B����һ�������·�Ӧ���ﵽƽ��ʱC���������Ϊa;����A��B��C��ʼͶ������ʵ����ֱ�Ϊn(A)��n(B)��n(C)������ͬ�����´ﵽƽ��ʱ��C���������ҲΪA�������й�������ȷ����
xC(g)��3mol A��2mol B����һ�������·�Ӧ���ﵽƽ��ʱC���������Ϊa;����A��B��C��ʼͶ������ʵ����ֱ�Ϊn(A)��n(B)��n(C)������ͬ�����´ﵽƽ��ʱ��C���������ҲΪA�������й�������ȷ����
A������ﵽƽ��ʱ��A��B��C������1mol����B��ת����һ������
B������ƽ������ټ���6mol A��4mol B�����C�������������a���ɶ϶�x��4
C����x=2������ϵ����ʼ���ʵ���Ӧ���㣺3n(B)=n(A)-3
D������ϵ����ʼ���ʵ�������3n(c)+4nA=12nB������ƶϣ�x=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ������
���³�ѹ�¶���1 mol(����)������ӻ�ѧ�������յ��������γ�1 mol(����)������ӻ�ѧ�����ų���������Ϊ����(��λΪkJ��mol��1)���±���һЩ��������(kJ��mol��1)��
��ѧ�� | ���� | ��ѧ�� | ���� | ��ѧ�� | ���� |
C��F | 427 | C��Cl | 330 | C��I | 218 |
H��H | 436 | S��S | 255 | H��S | 339 |
������������⡣
��1���ɱ������ݹ���Ԥ��C��Br���ļ��ܷ�Χ��_ <C��Br����< (��д��ֵ�͵�λ)
��2���Ȼ�ѧ����ʽ2H2(g)��S2(g)=2H2S(g) ��H�� Q kJ��mol��1����Q�� __
��3�� ��֪�����Ȼ�ѧ����ʽ��
O2 (g) = O (g)��e�� ��H1�� ��1175.7 kJ��mol��1
(g)��e�� ��H1�� ��1175.7 kJ��mol��1
PtF6(g)��e��= PtF (g) ��H2�� ��771.1 kJ��mol��1
(g) ��H2�� ��771.1 kJ��mol��1
O PtF
PtF (s) = O
(s) = O (g)��PtF
(g)��PtF (g) ��H3�� ��482.2 kJ��mol��1
(g) ��H3�� ��482.2 kJ��mol��1
��ӦO2(g) ��___ ___(g)��O PtF
PtF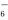 (s) ��H��___ ___kJ��mol��1��
(s) ��H��___ ___kJ��mol��1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com