

分析 (1)加入碳粉,可与铁形成原电池反应,待反应完全,取出冷却,再加入6mol•L-1的硫酸2mL,增大氢离子浓度,可抑制亚铁离子的水解;
(2)硫酸亚铁铵在乙醇中的溶解度较小;
(3)金属阳离子为亚铁离子,可被氧化生成铁离子,可与铁氰化钾反应生成蓝色沉淀;
(4)读数时应保持滴定管自然悬垂,视线与刻度线、凹液面最低处切线相平齐,以避免误差,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,n(KMnO4)=0.0100mol•L-1×0.018L=1.8×10-4mol,结合方程式计算.
解答 解:(1)加入碳粉,可与铁形成原电池反应,可加快反应速率,待反应完全,取出冷却,再加入6mol•L-1的硫酸2mL,增大氢离子浓度,可抑制亚铁离子的水解,
故答案为:为了形成原电池加快反应速率;加入硫酸抑制Fe2+的水解;
(2)硫酸亚铁铵在乙醇中的溶解度较小,加入乙醇,可降低硫酸亚铁铵的溶解度有利于结晶析出,故答案为:降低硫酸亚铁铵的溶解度有利于结晶析出;
(3)金属阳离子为亚铁离子,可被氧化生成铁离子,可与铁氰化钾反应生成蓝色沉淀,检验方法是取少量产品于试管中滴加KSCN无现象,滴加氯水后溶液显红色(取少量产品于试管中加水溶解,滴加氢氧化钠溶液后,有白色沉淀生成,迅速转变为灰绿色,最终变为红褐色或取少量产品于试管中加水溶解,滴加铁氰化钾有蓝色沉淀生成),
故答案为:取少量产品于试管中滴加KSCN无现象,滴加氯水后溶液显红色(取少量产品于试管中加水溶解,滴加氢氧化钠溶液后,有白色沉淀生成,迅速转变为灰绿色,最终变为红褐色或取少量产品于试管中加水溶解,滴加铁氰化钾有蓝色沉淀生成);
(4)a.滴定过程中眼睛注视锥形瓶内颜色的变化,故a错误;
b.滴定完成后取下滴定管,应握住旋塞部分,防止脱落,故b错误;
c.读数过程中保持滴定管自然悬垂,防止出现误差,故c正确;
d.读数时视线与刻度线、凹液面最低处切线相平齐,防止出现误差,为正确操作,故d正确,
反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,n(KMnO4)=0.0100mol•L-1×0.018L=1.8×10-4mol,由离子方程式可知n(Fe2+)=5×1.8×10-4mol=9×10-4mol,则1.9600g 配成100mL溶液,含有n((NH4)2SO4•FeSO4•6H2O)=5×9×10-4mol=4.5×10-3mol,
m((NH4)2SO4•FeSO4•6H2O)=4.5×10-3mol×392g•mol-1=1.764g,
则纯度为$\frac{1.764}{1.960}×100%$=90%.
故答案为:cd;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;90%.
点评 本题考查物质的含量的测定,为高频考点,侧重考查学生的分析能力、实验能力和计算能力,注意把握物质的性质以及实验的原理,把握关系式法的计算以及应用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入酚酞显红色的溶液:Na+、Fe3+、NO3-、Cl- | |
| B. | 0.1mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| C. | 0.1mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl- | |
| D. | 水电离出的c(H+)浓度为10-12的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向生石灰中滴加浓氨水以制备纯净的氨气 | |
| B. | 用分液漏斗分离碘和四氯化碳 | |
| C. | 用排饱和硝酸钾溶液法收集铜与浓硝酸反应产生的NO | |
| D. | 向含Al3+的氯化镁溶液中加入过量MgO,过滤得到MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A在一定条件下有如图所示的转化关系.
,A在一定条件下有如图所示的转化关系.
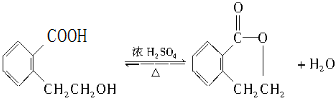 ,写出所有符合下列要求的E的同分异构体的结构简式:
,写出所有符合下列要求的E的同分异构体的结构简式: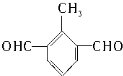 、
、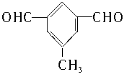 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
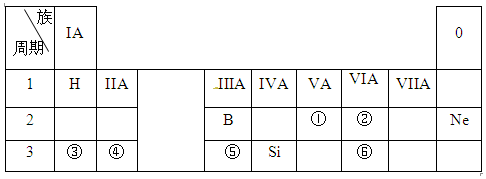
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com