
| A. | 可燃物在燃烧时所显示的火焰颜色 | |
| B. | 所有元素在灼烧时都有焰色反应 | |
| C. | 多种金属或它们的化合物灼烧时所显示的火焰颜色 | |
| D. | 焰色反应是一种化学反应 |
分析 A.某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的焰色反应;
B.焰色反应是某些金属元素的性质,不是所有元素都具有焰色反应;
C.某些金属或它们的化合物具有焰色反应;
D.焰色反应是物理反应;
解答 解:A.焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,故A错误;
B.由焰色反应的概念可知,并不是所有的金属元素都存在焰色反应,Fe不具有焰色反应,故B不选;
C.由焰色反应的概念可知,焰色反应是金属元素在灼烧时火焰所呈现的颜色,即多种金属或它们的化合物灼烧时所显示的火焰颜色,故C正确;
D.焰色反应的本质是原子内的电子获得能量后激发到能级较高的电子层,之后跃迁回原电子层时发出电磁波,当电磁波波长位于可见光范围内时即产生焰色反应,属于物理变化,故D错误;
故选C.
点评 本题主要考查了焰色反应,难度不大,需要注意的是焰色反应是物理变化,不是化学变化.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的氢化物的水溶液酸性比Y的氢化物的水溶液酸性强 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
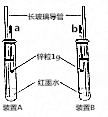 某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.
某化学兴趣小组按图示装好了实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸.实验时同时完全捏扁a、b的胶头,观察实验现象.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
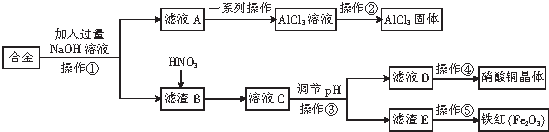
| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75% | B. | 80% | C. | 85% | D. | 90% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通人过量CO2制Al(OH)3:AlO2-+CO2+H2O═Al(OH)3↓+HCO3- | |
| D. | 向含2molAlCl3的溶液中加入1L 7mol/L的NaOH溶液:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com